外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用
标题: 巨噬细胞成为肿瘤帮凶的又一证据:协助传递肿瘤EVs组分... [打印本页]
作者: admin 时间: 2018-11-27 18:49
标题: 巨噬细胞成为肿瘤帮凶的又一证据:协助传递肿瘤EVs组分...
巨噬细胞成为肿瘤帮凶的又一证据:协助传递肿瘤EVs组分促进肿瘤进展
肿瘤来源的胞外囊泡(Tumor-derived extracellular vesicles,TEVs)可经由血液循环至特定的器官,从而在新的器官形成转移前灶,有利于肿瘤转移。有文献报道成纤维细胞等基质细胞在摄取TEVs后,能迅速增殖,并且分化成肿瘤相关的成纤维细胞(Cancer associated fibroblast,CAF),进而改变转移灶内的微环境,促进后续的转移。另外,TEVs也被报道能被间皮细胞摄取,使其发生间质转化。但是, TEVs如何在体内传输,分布和作用于靶细胞,TEVs的何种组分影响了基质细胞,这些问题我们仍不清楚。
在肿瘤腹腔转移过程中,腹膜间皮细胞(Peritoneal mesothelial cells,PMCs)能发生间皮间质转化,分化成肌成纤维细胞,促进纤维化进程,进而影响后续的肿瘤转移。以往的研究发现PMCs介导了肿瘤入侵胃壁内部的过程。胃壁由上至下可分为表皮绒毛,上皮层,固有层,粘膜层,浆膜层,肌层。研究人员在粘膜层注射TEVs后,发现PMCs能迁移至胃壁内部的浆膜层,肿瘤细胞也随之侵袭至胃壁的浆膜层。此外,在胃癌的人体标本里也能观察到胃壁内的PMCs的存在,同时也能发现有很多巨噬细胞的浸润。于是研究人员猜测,巨噬细胞可能在TEVs影响基质细胞的过程中发挥了一定的作用。
肿瘤组织浸润的巨噬细胞(Tumor-associated MΦs,TAMs)可通过多种途径促进肿瘤的发生发展。首先,TAMs可分泌多种前炎性因子TNFα,IL-1β,IL-6,生长因子VEGF和bFGF,和基质金属蛋白酶,促进肿瘤的转移。同时,M2型巨噬细胞可抑制T细胞的增殖,减弱免疫系统对肿瘤的杀伤作用。此外,TAMs也能使其周边的肿瘤细胞发生上皮间质转化,从而增强肿瘤细胞的恶性程度。
首先,研究人员使用胃癌细胞系44As3和CAF共培养上清中的TEVs处理巨噬细胞,发现TEVs能使TAMs表达更多的炎性因子,基质金属蛋白酶和其他免疫抑制分子。当这种TAMs与成纤维细胞共培养后,TAMs能将内含的EVs组分释放并传递给成纤维细胞,包括癌症相关的蛋白TGF-β,Wnt3,HIF1α,活化的Src和其他相关RNA。这一过程依赖于TAMs内的Caspase 3活化,当使用Caspase抑制剂后,这一现象得到一定程度的缓解。
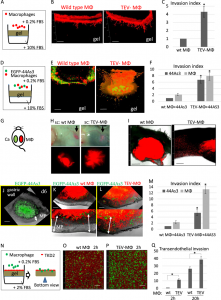
接着,研究人员在体外体内两方面验证了TAMs的上述作用对肿瘤侵袭的影响。体外,他们通过基质胶侵袭实验发现与对照组巨噬细胞相比,TEVs处理的TAMs(TEVs-MΦs)能更多地穿透基质胶。更有意思的是,TEVs-MΦs和44As3细胞共同培养后的混合细胞,也比对照组具有更强的侵袭能力。体内实验中,研究人员在背部两侧皮肤分别接种巨噬细胞和44As3细胞。结果显示TEVs-MΦs组皮肤内的TAMs分布很弥散,有明显向肿瘤一侧扩散的趋势,而对照组的巨噬细胞则是规则分布,边缘清晰。此外,在原位胃癌模型中,与对照组混合细胞或者单纯肿瘤细胞相比,TEVs-MΦs和44As3细胞共同培养后的混合细胞能更深地侵入至胃壁内部。这些结果证明TEVs-MΦs本身具有更强的侵袭能力,同时能促进胃癌细胞的侵袭能力增强(F1)。
最后,研究人员还发现TEVs-MΦs能使PMCs发生间皮间质转化。与TEVs-MΦs共培养后,PMCs上调表达Ncadherin,Vimentin,Slug,αSMA和FAP等间质细胞标志物(F2)。
在本项研究中,研究人员发现了TAMs传递TEVs内的效应成分至基质细胞,介导肿瘤细胞和基质细胞间通讯的新作用。在肿瘤恶化的进程中,肿瘤局部浸润的巨噬细胞会受到TEVs的影响,将TEVs吞噬后,携带其内含物并释放给基质细胞PMCs,引起PMCs发生间皮间质转化,分化为CAF,从而促进肿瘤的进一步侵袭。这一研究发现提出了TEVs通过巨噬细胞促进肿瘤进展的新机制,为肿瘤治疗提供了新的靶点。
Figure 1: TEVs-MΦs协同促进44As3胃癌细胞侵袭胃壁组织
Figure 2: TEVs-MΦs促进PMCs的间皮间质转化
参考文献:
Umakoshi, M., et al. Macrophage-mediated transfer of cancer-derived components to stromal cells contributes to establishment of a pro-tumor microenvironment. Oncogene (2018).
附件已隐藏,回复该贴可查看附件
作者: 15160963401 时间: 2018-11-29 14:10
XIEXIELOUZHU
作者: 15006181200 时间: 2018-11-29 19:47
谢谢楼主
作者: 扫尽尘嚣 时间: 2018-11-30 09:33
谢谢楼主,感谢!!!!!!!!!!!!
作者: 玉辇龙章 时间: 2019-2-21 23:02
期待查看
| 欢迎光临 外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用 (http://exosome.com.cn/) |
Powered by Discuz! X3.3 |