外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用
标题: NCB:LC3介导RNA结合蛋白及相关RNA分选进EVs中的机制 [打印本页]
作者: admin 时间: 2020-1-30 10:09
标题: NCB:LC3介导RNA结合蛋白及相关RNA分选进EVs中的机制
NCB:LC3介导RNA结合蛋白及相关RNA分选进EVs中的机制
近日,来自加州大学旧金山分校(UCSF)的Jayanta Debnath 教授在Nature Cell Biology杂志(影响因子17.728)上发表文章,报道了LC3偶联机制介导将RNA结合蛋白装载到细胞外囊泡中。
尽管自噬常常被视为溶酶体降解过程,但遗传证据暗示自噬途径组分(autophagy pathway components, ATG)处于分泌状态,包括炎性细胞因子的常规分泌、溶菌酶的细胞外释放、分泌性溶酶体的有效释放,EV的产生和缺少氨基末端前导肽或信号序列蛋白质的非常规分泌。这些过程统称为分泌自噬,在正常情况下和疾病发作期间都暗示着自噬途径参与细胞命运决定和组织微环境的非细胞自主控制。然而,我们对分泌自噬的理解仍然不多。首先,除了数量有限的蛋白质靶标外,自噬依赖性分泌组仍未表征。此外,迄今为止的研究在很大程度上依赖于ATG遗传功能丧失后的表型分析,该研究无法辨别分泌缺陷是否代表自噬受损的直接还是间接后果。该研究描述了一种分泌自噬途径,LC3介导将蛋白质和RNA货物装载到EV中,从而分泌到细胞外。
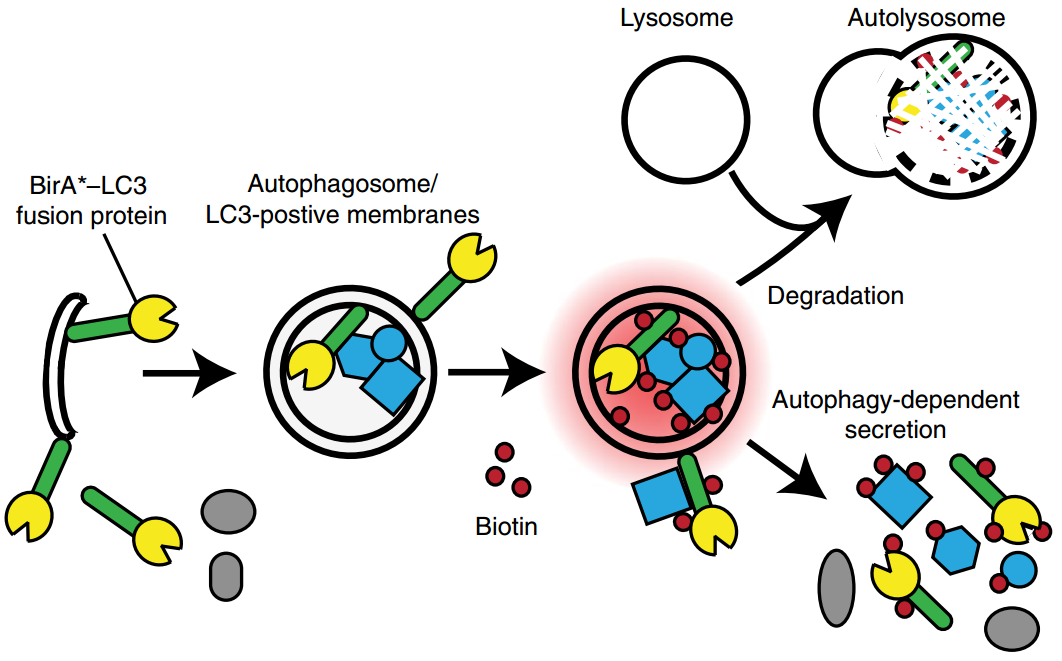
邻近依赖性生物素化策略标记分泌自噬靶蛋白
该研究证明自噬机制的组分参与细胞外囊泡(EVs)内的分泌。使用邻近依赖性的生物素化蛋白质组学策略,该研究确定了LC3依赖性分泌的200个推测靶标。该分泌组由高度互连的网络组成,该网络富含RNA结合蛋白(RBP)和EV货物。EV的蛋白质组学和RNA谱分析可识别各种RBPs和小的非编码RNA,这些蛋白需要LC3缀合机制进行包装和分泌。其中两个RBPs,异质核糖核蛋白K(HNRNPK)和支架附着因子B(SAFB),与LC3相互作用,并在富含脂质LC3的EV内分泌。此外,它们的分泌需要LC3偶联机制,中性鞘磷脂酶2(nSMase2)和依赖LC3的与nSMase2活性相关的因子募集(FAN)。因此,LC3偶联途径控制着EV货物的装载和分泌。
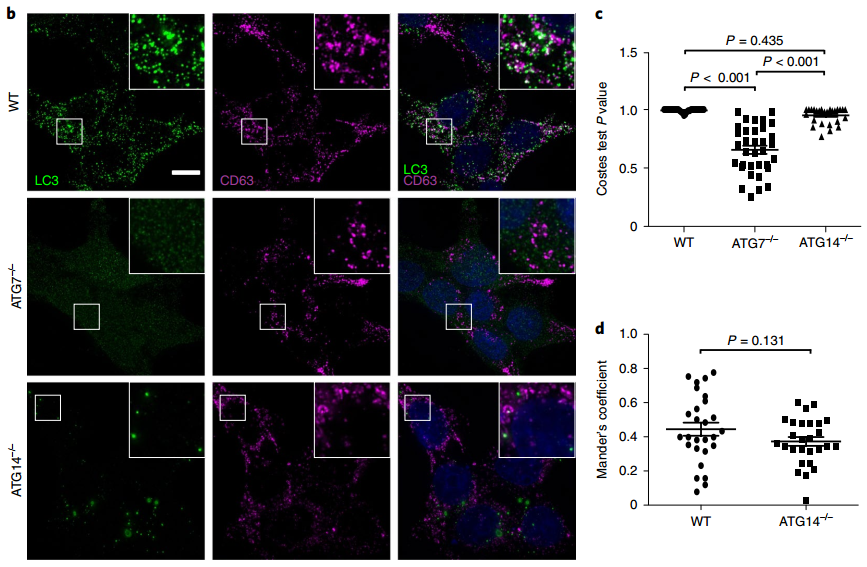
内源性LC3与EV相关的四跨膜蛋白共定位
总之,该研究证明了LC3和LC3偶联机械将货物装载到EV中。先前的工作已经使自噬与EV产生之间建立了紧密的联系。例如,之前的工作研究了ATG12和ATG3之间的复合物,该复合物与ESCRT辅助蛋白ALIX(PDCDIP6)相互作用并调节小EV释放。此外,发现自噬蛋白ATG5和LC3通过控制ATP6V1E1与V1V0-ATPase复合物的相互作用来协调调节MVB酸化和外泌体产生。 此外,由于晚期内体可以融合到未成熟的自噬体上,因此EV生物发生和自噬被认为在功能上是相关的。这项研究描述了一个称为LDELS的过程,强调了LC3偶联机制在指定包装到EV中的货物方面的独特作用,这是一项全新的发现。
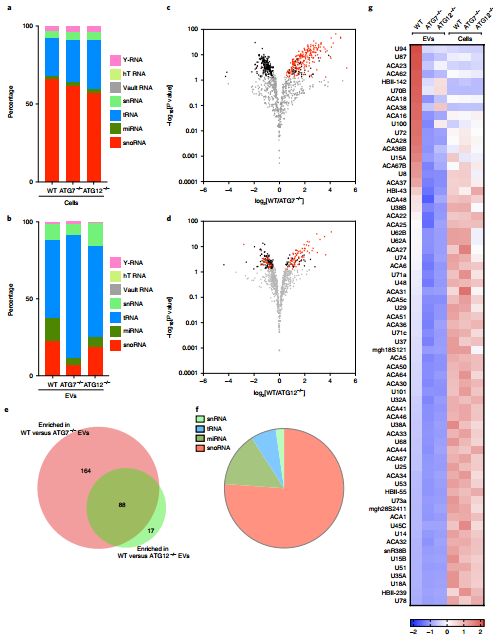
依赖LC3的EV货物装载和分泌机制(LDELS)调节EV中的小非编码RNA组成
重要的是,LC3和LDELS中的缀合机制的这些功能不同于它们在经典自噬中已确立的作用。作者提出,LDELS而不是位于早期自噬中间体的LC3,使用位于MVB膜上的LC3-II库直接捕获RBP并将其包装进ILV;这些随后通过与质膜的MVB融合而作为EV释放。因此,LDELS与自噬相关途径相似,在这些途径中,LC3-II被递送至溶酶体系统中的单个膜,包括LC3相关的内吞作用、LC3相关的吞噬作用、细胞侵入性死亡(Entosis)和大内吞过程。LDELS还需要nSMase2和LC3依赖的FAN募集。实际上,由nSMase2产生的神经酰胺可以驱动膜微区的形成,促进MVB膜上不依赖ESCRT的腔内出芽。与许多ESCRT组件的情况相反,该研究尚未在EV内检测到FAN,这表明FAN只能与MVB膜上的LC3短暂相互作用,或者可以远程作用以促进来自其他隔室(例如内质网或高尔基体)的LDELS,与MVB货物分拣中的组织间通信的新兴角色保持一致。
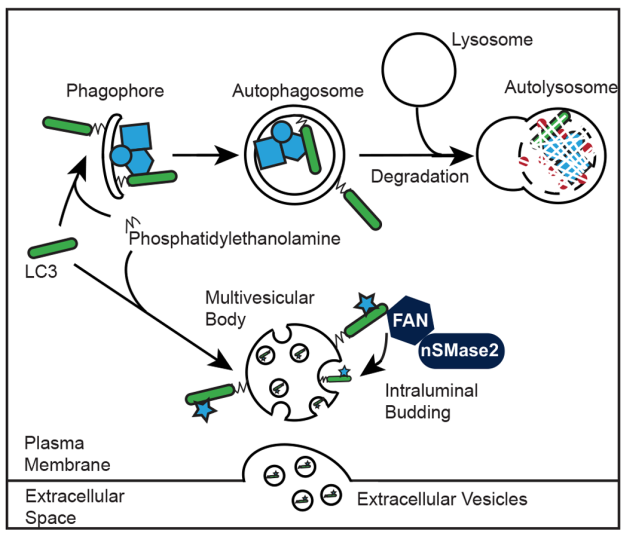
模式图
EV最初被描述为一种从细胞中选择性清除蛋白质、脂质和核酸的机制,在各种生理和病理过程中,EV正在成为一种重要的细胞间通讯方式。 阐明依赖LC3的EV货物装载和分泌机制(LDELS)如何影响体内细胞间通讯和非细胞自主功能仍然是未来研究的重要课题。 总体而言,该研究扩展了分泌自噬的假定靶标库,并定义了一种先前无法识别的机制,通过该机制,LC3缀合机制可将货物装载到EV中。
参考文献:
Leidal AM, Huang HH, Marsh T, Solvik T, Zhang D, Ye J, Kai F, Goldsmith J, Liu JY, Huang YH, Monkkonen T, Vlahakis A, Huang EJ, Goodarzi H, Yu L, Wiita AP, Debnath J. The LC3-conjugation machinery specifies the loading of RNA-binding proteins into extracellular vesicles. Nature Cell Biology. 2020 Jan 13. doi: 10.1038/s41556-019-0450-y. [Epub ahead of print] IF=17.728
| 欢迎光临 外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用 (http://exosome.com.cn/) |
Powered by Discuz! X3.3 |