外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用
标题: Nature重磅:p53缺失通过细胞外囊泡驱动头颈癌神经元重编程 [打印本页]
作者: Johnny 时间: 2020-2-20 23:30
标题: Nature重磅:p53缺失通过细胞外囊泡驱动头颈癌神经元重编程
本帖最后由 Johnny 于 2020-2-20 23:30 编辑
Nature重磅:p53缺失通过细胞外囊泡驱动头颈癌神经元重编程
近日,德州大学MD安德森癌症中心的研究人员在Nature杂志(影响因子43.07)上发表文章,报道发现,癌细胞失去一种重要的抑癌基因p53后,头颈癌可以通过细胞外囊泡(EVs)将信号传递到附近的神经元上去,改变其功能并将其召集到肿瘤中,从而促进肿瘤生长。
实体瘤微环境包括源自周围神经系统的神经纤维。最近的研究表明,新形成的肾上腺素能神经纤维可以促进肿瘤的生长,但是这些神经的起源及其发生的机制尚不清楚。最新一项发表在Nature的研究通过比较口腔癌小鼠模型中与癌症相关的三叉神经感觉神经元和内源性神经元的转录组,确定了肾上腺能分化标志。研究表明,TP53的丢失通过miR-34a的丢失导致与肿瘤相关的感觉神经的肾上腺素能转分化。肾上腺素能受体的感觉去神经支配或药理学阻滞抑制了肿瘤的生长,但先前存在的肾上腺素能神经的化学交感神经切除术并未抑制肿瘤的生长。对口腔癌样品的回顾性分析显示,p53的状态与神经密度有关,而神经密度又与不良的临床结果有关。癌细胞与神经元之间的这种串扰代表了将与肿瘤相关的神经元重新编程为可刺激肿瘤进展的肾上腺素能表型的机制,并且是抗癌治疗的潜在目标。
下文仅介绍细胞外囊泡相关的研究内容。
癌症来源的囊泡控制神经形成
为了研究神经营养信号传递到神经的途径,将背根神经节(DRG)与OCSCC细胞培养物的条件培养基的癌症衍生的可溶性组分和细胞外囊泡(EV)组分一起孵育。
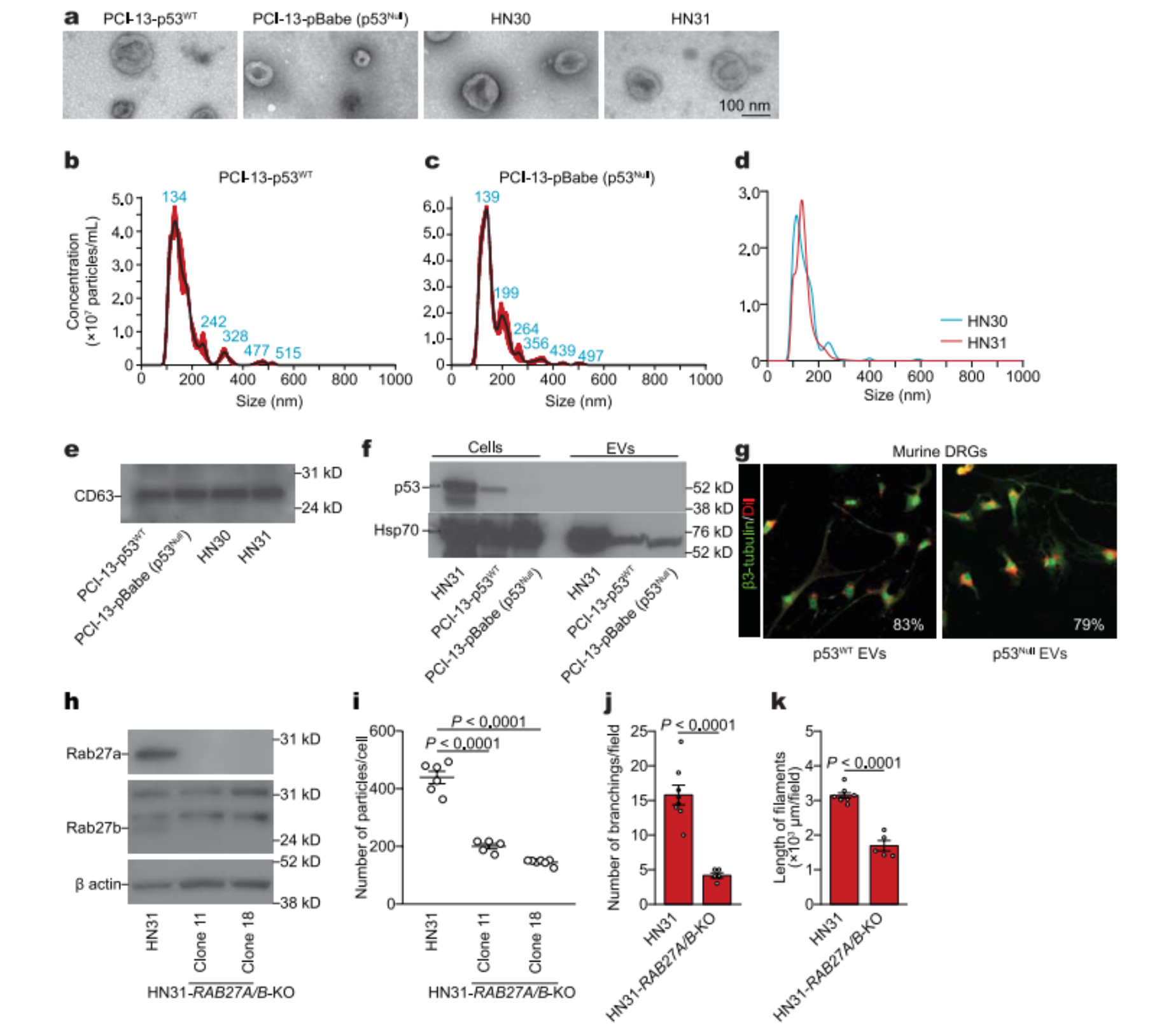
口腔鳞状细胞癌(OCSCC)的EVs和神经发生
用p53缺失细胞的EVs培养的DRG的神经纤维比用相应EV去除的条件培养基或p53野生型细胞的EVs培养的神经纤维更多。
用可溶性因子(EVs去除的条件培养基)或来自PCI-13细胞的EVs处理的DRG中的体外神经形成
为了评估EVs对神经形成的潜在影响,使用HN31细胞(具有导致功能缺陷的内源性p53C176F和p53A161S突变的人OCSCC细胞系)和缺乏GTPases RAB27A和RAB27B的HN31 RAB27A-/-RAB27B-/-细胞的条件培养基。在体外和在体内将OCSCC细胞异种移植,RAB27A和RAB27B的敲除显著降低了DRG神经形成。因此,神经元似乎是p53缺陷癌细胞的EVs的主要基质靶标。
癌症衍生的miRNA驱动轴突生成开关
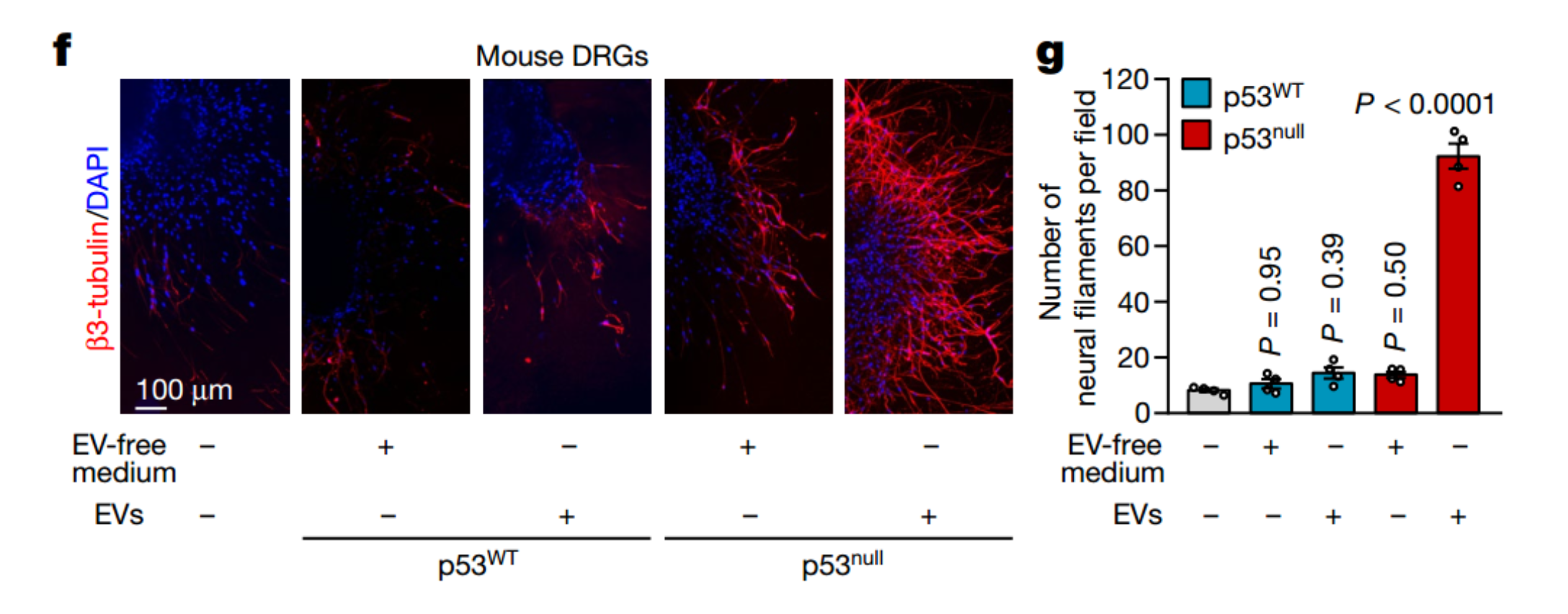
小RNA是神经元发育、再生和功能的关键调节剂,而EV是RNA在细胞之间转移的主要途径。通过比较来自p53野生型和缺乏的细胞系的EV的miRNA谱,研究鉴定了17个与p53变化相关的miRNAs。与p53null细胞相比,p53WT细胞衍生的EV中miR-34a-5p和miR-141-5p的表达显著增加,但其它15种miRNAs没有显著增加。
为了研究miR-34a和miR-141如何与其它源自癌的EV信号相互作用以介导轴突发生,该研究将含有antagomiR-34a或antagomiR-141的三叉神经节(TG)神经元与来自p53WT OCSCC细胞的含有大量miR-34a和miR-141的EV共培养。与非特异性antagomiR或no-EV对照相比,两种antagomiRs均增加了神经丝的数量,antagomiR-34a具有显著的作用。相反,用miR-34a转染TG神经元(与scramble miRNA或无EV对照相比),然后与源自p53null OCSCC细胞的miR-34a缺陷型EV共培养,显著减少了神经纤维的数量。TG神经元与源自miR-34a缺失的p53WT OCSCC细胞的EV共培养,与没有EV或没有敲除相同细胞的EV相比,体外神经丝的数量显著增加。与未敲除的相同细胞相比,在p53WT OCSCC细胞中敲除miR-34a的体内神经突也有所增加。总之,这些数据支持以下观点,即,EV传递OCSCC衍生的miR-34a到癌症相关的神经元产生EV相关的轴突生成负调节信号。
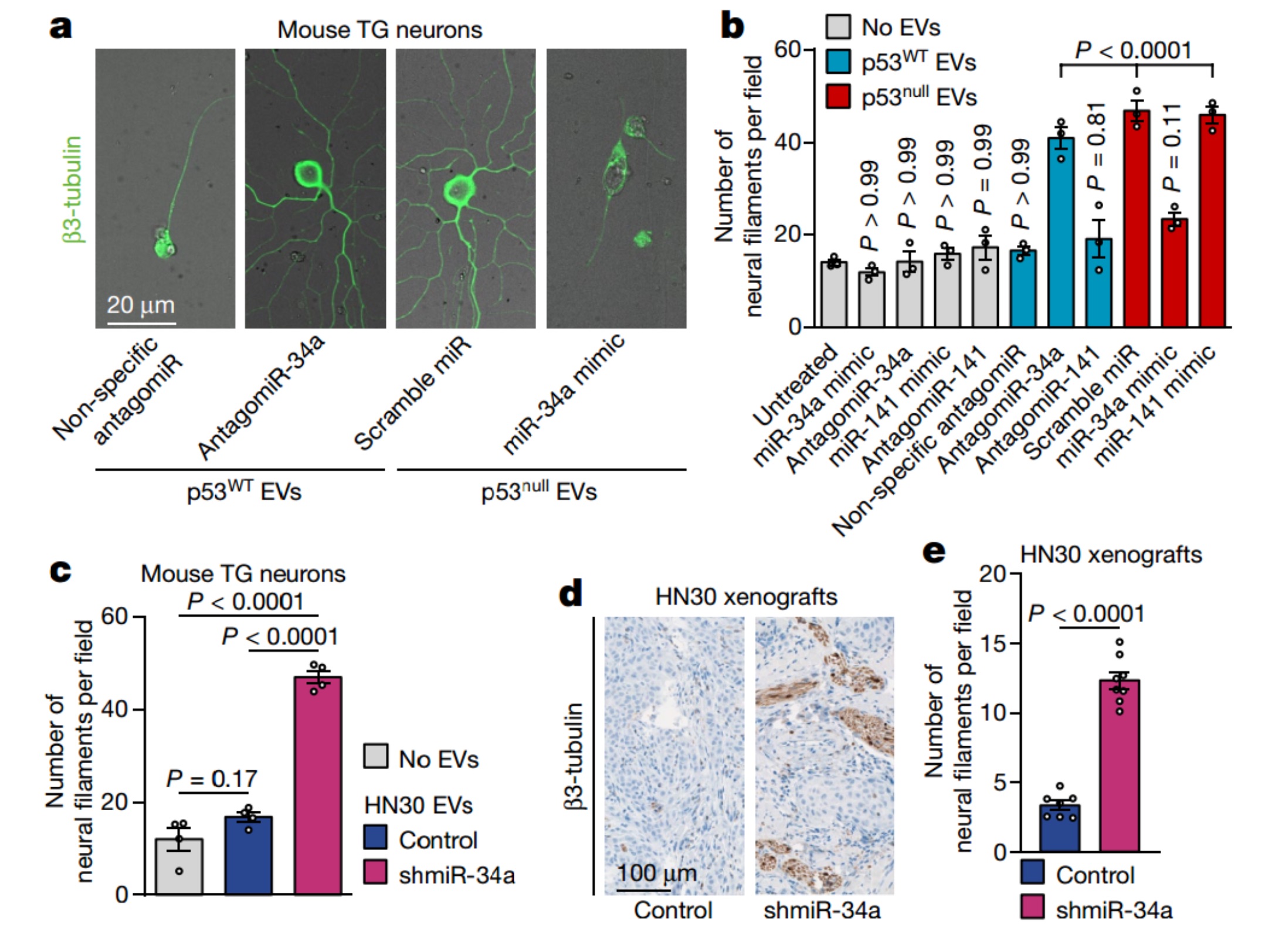
p53依赖的miRNA成分改变调控神经形成
EVs驱动感觉神经重编程
为了评估OCSCC衍生的EV对神经元转录程序的影响,该研究对与p53null或p53WT OCSCC细胞的EV共培养的人DRG神经元进行了RNA测序。RNA测序数据的主成分分析表明,用p53WT OCSCC细胞的EV培养的神经元与用p53null OCSCC细胞的EV培养的神经元是分离的。通路分析表明,后一组神经元中差异表达的基因丰富了神经元的生长和形态、突触、分化、干性和突触传递。为了评估p53对与癌症相关的神经元分化的影响,研究分析了在MD安德森癌症中心接受治疗的OCSCC患者进行舌状切除术期间切除的组织样本中神经纤维的密度。对自主神经系统交感神经和副交感神经分支的评估表明,TP53mut OCSCC中酪氨酸羟化酶(TH,肾上腺素能)阳性但囊泡乙酰胆碱转运蛋白(副交感神经)阳性的纤维比TP53WT肿瘤中的纤维密度显著更高。结果表明,近端肾上腺素能神经元的募集与源自p53缺乏肿瘤的信号有关。
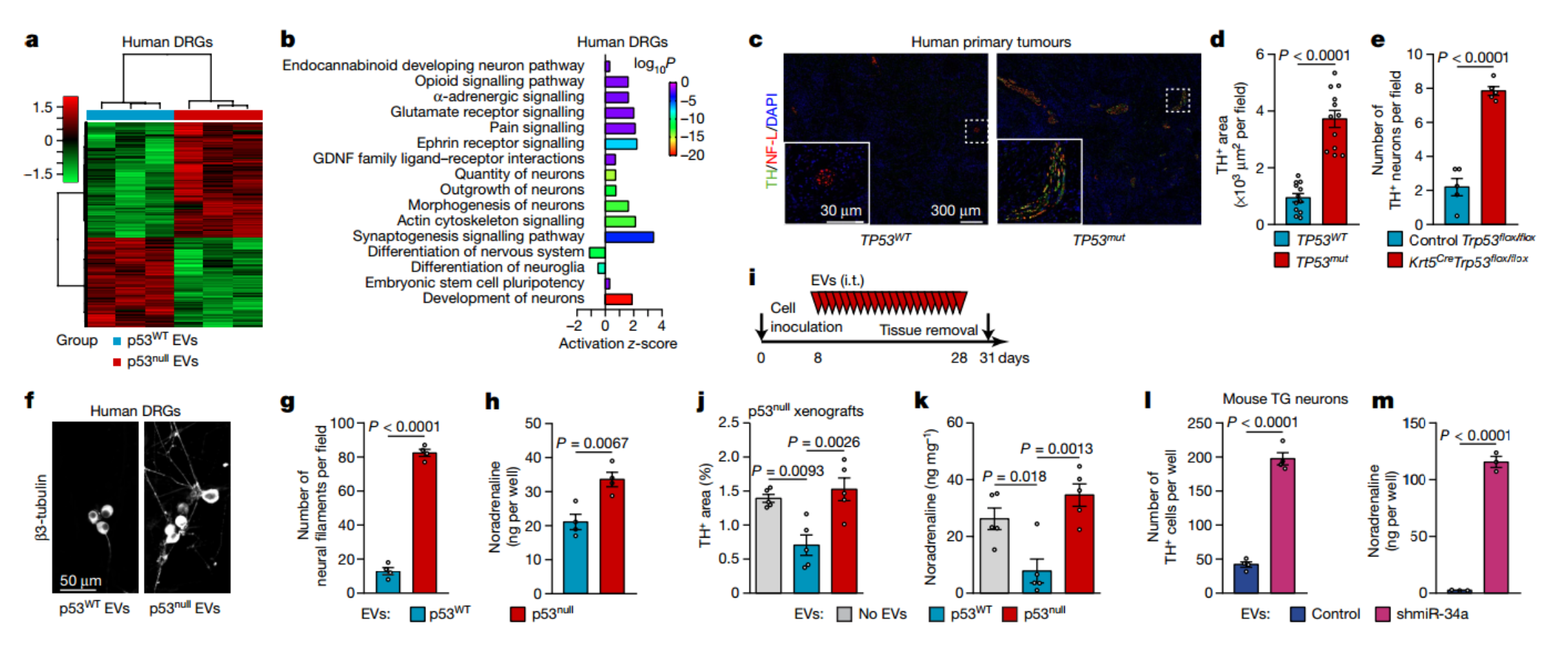
缺乏p53的肿瘤富含肾上腺能神经纤维
随着肿瘤的发展,新的神经网络在肿瘤基质内及其周围发展,提供协调癌症进展的信号。这些结果与最近的临床前数据一致,表明交感神经纤维在实体瘤组织的附近积聚并渗入基质中。此外,临床数据显示,接受β受体阻滞剂治疗的癌症患者的生存期得到了改善,支持了肾上腺能神经活动在癌症进展中的作用。尽管需要进一步的研究来剖析将肿瘤相关的神经形成与癌症进展联系起来的分子机制,但该数据提出了诱人的可能性,即针对轴突生长和肾上腺素能神经系统的药物或可用于治疗头颈癌。
参考文献:
Amit, M., Takahashi, H., Dragomir, M.P. et al. Loss of p53 drives neuron reprogramming in head and neck cancer. Nature (2020). DOI:10.1038/s41586-020-1996-3
附件已隐藏,回复该贴可查看附件
作者: zzc2211 时间: 2020-2-21 20:56
向看看原文,谢谢
作者: gangxiaxuan 时间: 2020-2-29 19:27
辛苦了楼主
作者: huyy09 时间: 2020-12-24 23:22
谢谢分享111111
| 欢迎光临 外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用 (http://exosome.com.cn/) |
Powered by Discuz! X3.3 |




