外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用
标题: Nature子刊:外泌体脂质谱分析高脂饮食诱导胰岛素抵抗机制 [打印本页]
作者: Johnny 时间: 2021-1-23 10:49
标题: Nature子刊:外泌体脂质谱分析高脂饮食诱导胰岛素抵抗机制
本帖最后由 Johnny 于 2021-1-23 10:49 编辑
Nature子刊:外泌体脂质谱分析,揭示高脂饮食诱导胰岛素抵抗机制
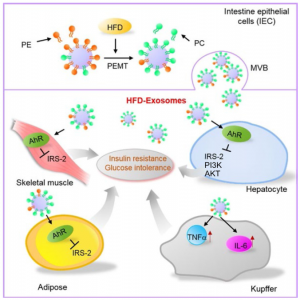
近日,美国肯塔基州路易斯维尔大学肿瘤预防中心主任张皇阁教授、YunTeng团队在Nature Communications杂志上发表文章,报道发现,高脂饮食(HFD)会显著改变肠道上皮外泌体的脂质谱,从主要的磷脂酰乙醇胺(PE)变为磷脂酰胆碱(PC),从而通过将外泌体PC与肝细胞中表达的AhR结合而抑制胰岛素反应并抑制胰岛素激活途径必不可少的基因。该研究结果揭示了一种饮食机制,通过这种机制可以塑造肠道上皮细胞的外泌体脂质谱,从而调节肝脏/肠轴的通讯。
全球肥胖和糖尿病的增多对健康提出了巨大挑战。胰岛素抵抗是2型糖尿病(T2D)的标志,并与代谢紊乱有关,但尚不清楚它们背后的分子途径之间的确切相互作用。已经提出了生物活性脂质在非脂肪组织中的积累,以促进胰岛素敏感性损害。异常高的细胞磷脂酰胆碱(PC)脂质会影响能量代谢,并与胰岛素抵抗有关。
高脂饮食(HFD)是一种公共健康问题,因为这可能使个体容易患上肥胖症和糖尿病,并促进PC和胰岛素抵抗的过度产生。从生理学角度来看,高脂饮食与胰岛素抵抗之间最重要的联系之一是肠-肝轴以及肠道和肝脏代谢产物释放的因子,这些因子介导了肠道与肝脏之间的双向交流。HFD后,肠肝轴受损。
最新数据表明,细胞外小泡(EVs)通过充当脂肪组织、肝脏、骨骼肌和免疫细胞之间的细胞间通讯方式,在肥胖及其代谢并发症的发展中发挥作用。外泌体可能在外周胰岛素敏感性的调节中起作用,外周胰岛素敏感性是T2D发病机理的主要组成部分。外泌体似乎通过至少两种不同的机制来调节胰岛素敏感性,即通过调节炎症或通过与胰岛素反应性器官的直接相互作用。后者可通过与主要胰岛素信号分子(例如磷脂酰肌醇3-激酶(PI3K)/ Akt信号通路)相互作用而影响胰岛素信号通路而直接或间接发生。与对照组相比,糖尿病患者的血浆EV含量更高,并且与对照组相比,糖尿病小鼠的血浆外泌体数量也更高。然而,确定外泌体的作用及其在肝/肠轴通讯中的潜在作用将需要对它们的组成有更好的了解,特别是饮食是否会改变肠源性外泌体的含量,因此就胰岛素反应而言它们的生物学功能尚未研究。
调节胰岛素反应的一种感兴趣的蛋白质是芳烃受体(AhR),它是一种配体激活的转录因子,可整合饮食和代谢线索以控制复杂的转录程序。确实,AhR过表达导致胰岛素抵抗。相反,种系AhR null小鼠具有增强的胰岛素敏感性和改善的葡萄糖耐量。此外,与具有高亲和力AhR的小鼠相比,表达低亲和力AhR等位基因的小鼠在暴露于HFD后更不容易肥胖,并且在脂肪量、肝脏生理学和肝细胞基因表达方面表现出差异。但是,在肝细胞中饮食介导的控制AhR、PC脂质和胰岛素途径信号传导之间关联的分子介体和机制尚不清楚。
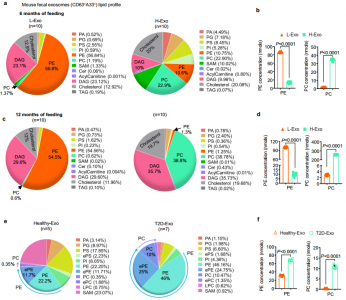
高脂饮食(HFD)改变肠上皮细胞释放的外泌体的脂质组成
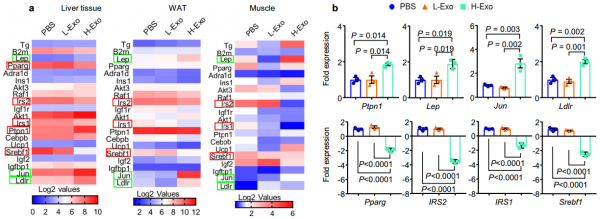
该研究显示,从喂食HFD的肥胖小鼠或II型糖尿病患者的粪便中分离出的外泌体给药瘦小鼠后,瘦小鼠变得具有胰岛素抵抗性。HFD将瘦动物的主要含磷脂酰乙醇胺(PE)的外泌体(L-Exo)的脂质组成改变为肥胖动物的外泌体(H-Exo)中的磷脂酰胆碱(PC)。从机制上讲,研究显示肠道H-Exo被巨噬细胞和肝细胞吸收,从而导致胰岛素信号通路的抑制。此外,外泌体来源的PC结合并激活AhR,导致抑制胰岛素激活信号通路必不可少的基因(包括IRS-2)及其下游基因PI3K和Akt。总之,结果表明,HFD诱导的外泌体可能是胰岛素抵抗发展的潜在因素。肠外泌体因此具有作为广泛治疗靶标的潜力。
H-Exo对肝脏、脂肪和肌肉组织中胰岛素信号的影响
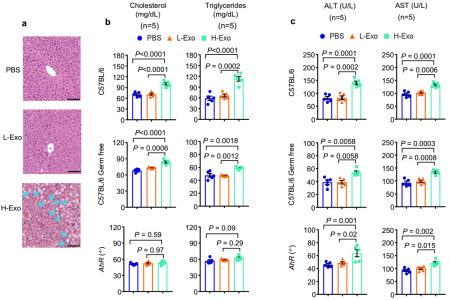
H-Exo在C57BL/6和C57BL/6germ-free小鼠中诱发肝脂肪变性和血脂异常,但在AhR-/-小鼠中不诱发
模式图
参考文献:KumarA, Sundaram K, Mu J, Dryden GW, Sriwastva MK, Lei C, Zhang L, Qiu X, Xu F, YanJ, Zhang X, Park JW, Merchant ML, Bohler HCL, Wang B, Zhang S, Qin C, Xu Z, HanX, McClain CJ, Teng Y, Zhang HG. High-fat diet-induced upregulation ofexosomal phosphatidylcholine contributes to insulin resistance. NatCommun. 2021 Jan 11;12(1):213. doi: 10.1038/s41467-020-20500-w.PMID: 33431899.附件已隐藏,回复该贴可查看附件
相关报道:https://www.exosomemed.com/6424.html
https://www.exosomemed.com/5239.html
作者: danizer 时间: 2021-1-28 16:57
感谢分享
作者: zgarycn 时间: 2021-1-29 23:53
感谢分享
作者: tiantubaye 时间: 2022-12-7 11:37
非常有用!
| 欢迎光临 外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用 (http://exosome.com.cn/) |
Powered by Discuz! X3.3 |