外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用
标题: Adv Sci:低pH环境下产生的肿瘤外泌体可用于智能药物递送 [打印本页]
作者: Johnny 时间: 2021-6-2 20:19
标题: Adv Sci:低pH环境下产生的肿瘤外泌体可用于智能药物递送
本帖最后由 Johnny 于 2021-6-2 20:19 编辑
Advanced Science:低pH环境下产生的肿瘤外泌体可用于智能药物递送,治疗其同源肿瘤
作为膜结合的细胞外囊泡,外泌体具有针对特定细胞类型的靶向能力,并且细胞环境强烈影响其含量和摄取效率。受到这些自然特性的启发,来自中国科学院过程工程研究所的马光辉研究员、魏炜研究员与上海交通大学医学院附属同仁医院王玉刚教授合作在Advanced Science杂志上发表文章,评估了各种细胞应激条件对肿瘤外泌体摄取效率的影响,并发现了低pH处理引起的摄取效率提高和保留的细胞类型特异性。脂质组学分析和分子动力学模拟揭示了基于甘油脂类自聚集的机制,可提高同源性。此外,将这些低pH重新编程的外泌体开放成为智能药物输送平台,该平台能够特异性靶向肿瘤细胞,并响应于近红外辐照触发的活性氧爆发而引起的外泌体破裂,选择性释放多种化学药物。多种模型小鼠实验所证明该平台发挥了安全和增强的抗肿瘤作用。这些结果为重编程外泌体开辟了一条新途径,以使外泌体能够智能地进行药物递送,并可能针对其同源肿瘤进行个性化治疗。
外泌体是大多数真核细胞释放的膜结合细胞外囊泡,大小范围为40至100 nm。已经发现它们不仅具有在细胞之间转移膜成分而且还可以转移核酸的能力,强调了它们在细胞间通讯中的作用。此外,许多体外和体内研究也突出了其独特的靶向能力。也就是说,外泌体能够克服自然障碍并利用内源性机制进行摄取、细胞内运输以及随后将其内容物递送至靶细胞。因此,利用外泌体作为药物载体以将各种治疗剂靶向递送至高度特异性细胞的生物技术应用具有相当大的吸引力。
最近,研究表明产生外泌体的局部细胞环境会强烈影响其细胞间的通信性能。例如,肿瘤缺氧微环境可以增加外泌体的释放,从而促进肿瘤血管生成和转移。酸性微环境也可能影响外泌体的性质,而外泌体的性质是影响肿瘤进展的关键因素。鉴于此,研究人员推测对培养条件的控制应该允许外泌体的性能调节以适合递送应用,并筛选出更好的条件。除了靶向递送之外,还尝试设计了响应特定的外部触发因素(例如,光、声、热和磁场),从而能够在病变部位选择性释放药物。在这方面,进一步推测开发具有外泌体的智能递送平台非常有价值,这可以进一步提高其靶向效率并减少副作用。
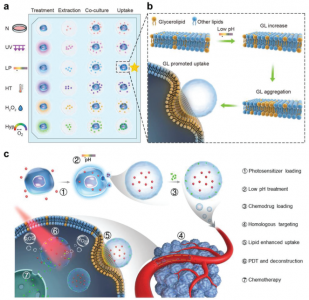
图1、增强外泌体细胞摄取的培养条件和机制及其抗肿瘤治疗应用
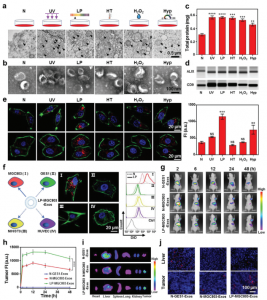
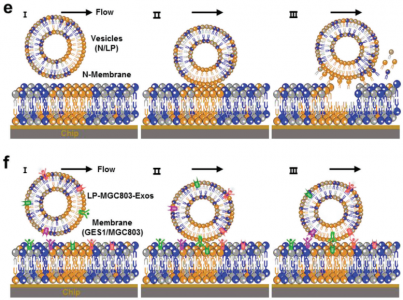
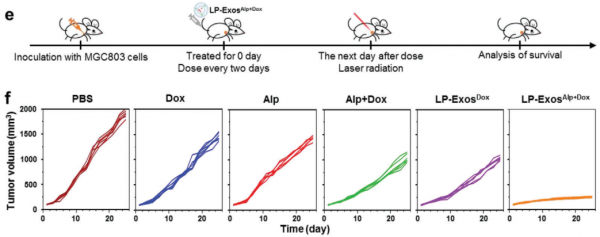
针对抗癌药物的传递,研究人员首先筛选了六种不同的细胞应激条件对人胃癌细胞系释放的外泌体摄取效率的影响(图1a)。研究发现,具有近似肿瘤微环境条件(例如,低pH和低氧)的细胞会导致肿瘤外泌体被亲代细胞的摄取显著增加,并且在低pH处理下最显著的增强并未降低动物水平的细胞特异性。进一步发现低pH重编程过程中脂质组成发生变化后,使用分子动力学模拟对这一概念进行了详细探讨,并发现肿瘤细胞及其外泌体之间的甘油脂自聚集是同源摄取增加的原因(图1b)。基于这些发现和低pH重编程的外泌体,通过将亲水性光敏剂和疏水性化学药物分别共同装载在外泌体的内腔和膜中,进一步开发了一个智能的药物递送平台(图1c)。静脉注射后,这些外泌体发挥了对肿瘤部位的靶向能力。随着进一步的近红外(NIR)激光照射,光敏剂可产生活性氧(ROS)引起外泌体破裂和随后的化学药物释放,从而导致增强的抗肿瘤作用且几乎没有异常(图1c)。使用患者衍生的异种移植(PDX)肿瘤模型,最终证实了低pH重编程后,患者肿瘤中原代细胞释放的外泌体还可以提高靶向递送至肿瘤区域的效率,并在智能化和个性化方面建立了可喜治疗效果的药物递送平台。
图2、筛选不同的培养方法以提高外泌体的摄取效率及其靶向特异性
低pH值外泌体(LP-Exos)的摄取增强的分子机制
双重负荷LP-Exos策略的抗癌治疗效果
参考文献:
GongC, Zhang X, Shi M, Li F, Wang S, Wang Y, Wang Y, Wei W, Ma G. Tumor ExosomesReprogrammed by Low pH Are Efficient Targeting Vehicles for Smart Drug Deliveryand Personalized Therapy against their Homologous Tumor. Adv Sci(Weinh). 2021 Mar 16;8(10):2002787. PMID: 34026432.
附件已隐藏,回复该贴可查看附件
作者: bddjs 时间: 2021-6-3 16:06
谢谢分享
作者: galaxy-蓬蓬 时间: 2021-6-6 23:22
感谢分享
作者: xingyll 时间: 2021-6-7 09:15
谢谢分享
作者: Mango1998 时间: 2021-10-13 10:56
谢谢分享
作者: dongfeng 时间: 2022-3-10 17:22
感谢分享
| 欢迎光临 外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用 (http://exosome.com.cn/) |
Powered by Discuz! X3.3 |