|
|
SciAdv: 非酒精性脂肪性肝病外泌体分泌的新机制
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是以肝细胞内脂质过度沉积为主要特征的临床病理综合征,已经逐渐成为全球慢性肝病最常见的病因之一。然而目前尚缺乏有效的NAFLD临床诊断标志物和治疗药物。外泌体是由多泡体(multivesicularbodies, MVB)与细胞膜融合后释放的一类细胞外囊泡。有研究表明外泌体数量在一些疾病发生发展过程中会发生变化,并可能成为潜在的疾病生物标志物。然而目前NAFLD患者外泌体水平变化及其调控机制尚未明确。
近日,青岛市市立医院辛永宁/庄立琨课题组在Science Advances期刊上发表了题为“Lipid-induced DRAM recruits STOM to lysosomes and induces LMPto promote exosome release from hepatocytes in NAFLD”的文章(2021, 7(45):eabh1541),报道了NAFLD患者血浆中肝细胞来源的外泌体水平明显升高,并揭示了溶酶体蛋白Damage-regulated autophagy modulator (DRAM)在脂质诱导肝细胞外泌体分泌中的作用及分子机制。

为了探究NAFLD患者血浆外泌体水平变化,研究者使用了超速离心分离外泌体后通过NTA检测外泌体数量、BCA检测外泌体蛋白水平以及ELISA检测磷脂酰丝氨酸三种方法评估了NAFLD患者血浆外泌体水平。三种方法的检测结果两两之间具有正相关性,并证明NAFLD患者血浆外泌体水平明显高于健康志愿者。进一步通过检测不同组织来源的外泌体标志物,研究者发现NAFLD患者血浆中肝组织来源的外泌体水平显著升高。
进一步通过GSEA分析GEO数据库中NAFLD患者肝组织基因表达的数据集,研究者发现外泌体分泌相关基因DRAM在高表达组中显著富集。并且早期NAFLD患者肝组织中DRAM的表达水平明显的高于健康对照组。使用肝组织中DRAM的表达水平区分早期NAFLD患者和健康志愿者,其受试者工作曲线(ROC)下面积(AUC)达到0.731。
为了探究DRAM在外泌体分泌中的作用,研究者使用CRISPR/Cas9构建的DRAM敲除小鼠以及DRAM敲低的肝细胞模型,均证明抑制DRAM表达能明显下调肝细胞外泌体的分泌,并且DRAM 敲除逆转了高脂饮食诱导的血浆外泌体水平的升高。
DRAM基因主要定位于溶酶体,溶酶体是分解细胞内生物大分子的细胞器,同时在外泌体生物发生过程中发挥重要作用。溶酶体膜透化(lysosomal membrane permeabilization, LMP)会导致溶酶体功能受损,包含有外泌体前体的MVB通过溶酶体途径降解减少,会更多的与细胞膜融合从而促进外泌体释放到细胞外。本研究进一步发现DRAM敲低能够明显抑制脂肪酸诱导的溶酶体膜透化,使用溶酶体抑制剂BafilomycinA1也能够恢复DRAM敲除对小鼠血浆外泌体水平的抑制效应。分子机制研究表明DRAM能够通过和stomatin (STOM)发生相互作用,促进STOM的溶酶体定位,诱导溶酶体膜透化,抑制MVB和溶酶体结合进而促进肝细胞外泌体分泌。
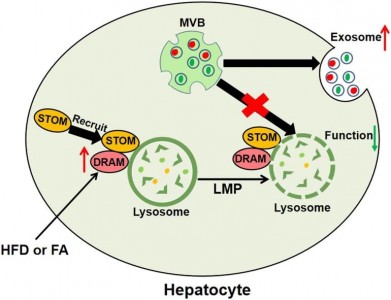
图1 脂质诱导的DRAM对肝细胞外泌体分泌的作用及机制模式图
综上,本研究不仅揭示了脂质诱导的DRAM介导外泌体分泌的作用及机制,并且提示血浆外泌体水平可作为NAFLD患者的一个新的生物标志物。
参考文献:
Lipid-induced DRAM recruitsSTOM to lysosomes and induces LMP to promote exosome release from hepatocytesin NAFLD. Sci Adv. 2021, 5;7(45):eabh1541. PMID: 34731006
|
|
 /1
/1 
 |Archiver|手机版|外泌体之家 | exosomes & microvesicles
|Archiver|手机版|外泌体之家 | exosomes & microvesicles
