外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用
标题: 《Nature Chemistry》:胞内体溶解多肽促进抗体的细胞质递送... [打印本页]
作者: 土豆 时间: 2017-7-12 20:49
标题: 《Nature Chemistry》:胞内体溶解多肽促进抗体的细胞质递送...
《Nature Chemistry》:胞内体溶解多肽促进抗体的细胞质递送,也可促进外泌体内含物进入细胞质发挥作用
小编前言:我们一直都很关注如何促进或抑制细胞的外泌体形成和释放,但较少关注外泌体被细胞摄取的是否有快慢多少之分?外泌体被细胞摄取后其内的物质一定会进入靶细胞的细胞质发挥作用吗?不会被溶酶体途径降解了吗?最新Nature Chemistry杂志上的这篇文章或许可以给我们一些新的看法。原来外泌体被细胞摄取后外泌体内的成分也不一定会发挥作用,有时候我们还需要促进被靶细胞胞吞进去的外泌体打破胞内体的膜进入细胞溶质才行。
分子和细胞生物学的最新进展揭示了细胞中的各种关键蛋白质,这对于开发针对许多疾病的新疗法是非常重要的。抗体是用于分子识别和靶向的最佳分子。为了使抗体进入细胞溶质发挥作用我们需要更清楚地了解靶蛋白的定位和特性。探究这些蛋白质的分子相互作用也可为揭示其生物学意义和作为治疗靶点的可行性提供信息。虽然以前已经报道了细胞内递送抗体和其他生物活性蛋白的方法,但仍然需要开发基于新概念的实用方法,以确保所递送的蛋白进入细胞质充分发挥作用,且无细胞毒性。
在细胞内使用抗体的主要障碍之一是它们很难从胞内体释放到细胞质中。抗体通过细胞内吞作用吸收进入细胞,这是一种封装到胞内体的生理摄取细胞外物质的过程。如果它们不能从胞内体释放到细胞溶质中,抗体就不能与其靶分子相互作用,并且最终可能在这些胞内体中降解。
为了克服这个问题,已经报道了许多方法,包括使用pH敏感的膜扰多肽和聚合物。这些分子被设计为根据胞内体内的pH降低来转换其结构并裂解胞内体膜。然而,目前的方法不足以实现抗体从胞内体的完全释放。这不仅降低了抗体的靶向功效,而且在细胞内分析和诊断过程中也导致不准确的信号。因此,要将胞内体包封的抗体100%释放到胞质溶胶中需要更好的新策略。
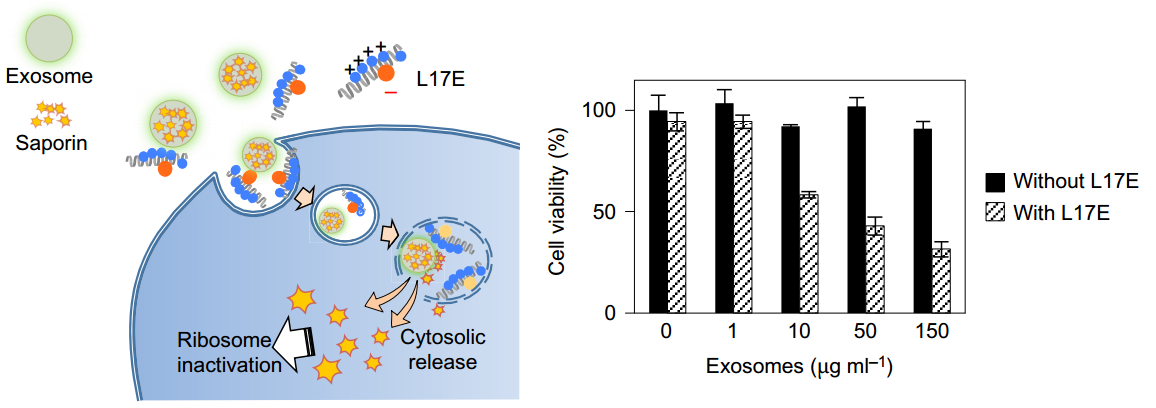
近日,来自日本京都大学的研究人员在Nature Chemistry上发表文章,报告了一种通过使用带阳离子的、具有膜裂解能力的蜘蛛毒多肽M-lycotoxin的胞内体溶解肽将蛋白质(包括抗体)递送到细胞中的方法。通过将一个或两个谷氨酸残基引入其疏水性表面来开发递送肽。谷氨酸取代亮氨酸(L17E)的这种多肽能够显著地从胞内体释放抗体(IgGs)到细胞溶质。该肽的主要膜扰动机制是优先破坏带负电荷的膜(胞内体膜),而不破坏中性膜(质膜),并且通过诱导大胞饮增加摄取。通过核糖体失活蛋白(saporin)、Cre重组酶和IgG递送的细胞内递送证实了该方法的保真度,其导致细胞溶质蛋白的特异性标记并随后抑制糖皮质激素受体介导的转录。该研究还展示了L17E可介导外泌体内蛋白质的胞质递送。
L17E也可以增强外泌体介导的细胞内物质递送效率。HeLa细胞用含核糖体失活蛋白(saporin)的外泌体处理1 小时,然后用带FBS的培液培液48小时。
通讯作者介绍
FUTAKI, Shiroh
二木 史朗(ふたき しろう)
京都大学化学研究所教授,主要研究方向为多肽及蛋白质工程化改造、细胞内化学、药物递送等。
前期发表的外泌体相关研究:
Nakase, I. and S. Futaki (2015). "Combined treatment with a pH-sensitive fusogenic peptide and cationic lipids achieves enhanced cytosolic delivery of exosomes." Sci Rep 5: 10112.
Nakase, I., et al. (2017). "Arginine-rich cell-penetrating peptide-modified extracellular vesicles for active macropinocytosis induction and efficient intracellular delivery." Sci Rep 7(1): 1991.
Nakase, I., et al. (2016). "Vectorization of biomacromolecules into cells using extracellular vesicles with enhanced internalization induced by macropinocytosis." Sci Rep 6: 34937.
Nakase, I., et al. (2016). "Receptor clustering and activation by multivalent interaction through recognition peptides presented on exosomes." Chem Commun (Camb).
Takeuchi, T., et al. (2015). "Intercellular chaperone transmission via exosomes contributes to maintenance of protein homeostasis at the organismal level." Proc Natl Acad Sci U S A.
参考文献:
Akishiba, M., et al. (2017). "Cytosolic antibody delivery by lipid-sensitive endosomolytic peptide." Nature Chemistry. doi:10.1038/nchem.2779 IF=25.87
附件已隐藏,回复该贴可查看附件
作者: 鱼儿 时间: 2017-7-13 00:20
谢谢分享
作者: xuxiaoxu 时间: 2017-7-13 05:12
感谢分享
作者: 杨云云 时间: 2017-7-13 07:55
感谢分享,谢谢!
作者: sdnujack 时间: 2017-7-13 08:26
学习学习!
作者: 生物小博 时间: 2017-7-13 09:04
很好的文献 可以学习下
作者: kibana 时间: 2017-7-13 09:15
谢谢。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。
作者: 简草苍苍 时间: 2017-7-13 09:26
好厉害的样子
作者: chenxiaolin1985 时间: 2017-7-13 09:49
作者: wqw131343 时间: 2017-7-13 13:35
这篇文献很有意思啊,我想看看这篇文献啊!
作者: 圈圈 时间: 2017-7-13 14:29
感觉很有意思的样子xixi
作者: qschenpeng 时间: 2017-7-13 16:46
感谢分享
作者: louxinhan 时间: 2017-7-13 17:00
感谢分享
作者: liuqizong123 时间: 2017-7-13 22:08
多谢分享
作者: Joyel 时间: 2017-7-16 17:49
谢谢。。。。
作者: gqq 时间: 2017-7-16 18:44
谢谢分享
作者: yriva 时间: 2017-7-17 11:05
支持,很好的文章
作者: 逢及时雨 时间: 2017-7-17 14:32



 看一看
看一看
作者: 八戒在五湖 时间: 2017-7-18 17:35
谢谢分享
作者: qyyzsy 时间: 2017-10-26 10:32
感谢分享
作者: atlanticocean 时间: 2017-10-26 16:03
xiexiexiexie
作者: MJZHANG 时间: 2021-2-8 17:00
感谢分享~
| 欢迎光临 外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用 (http://exosome.com.cn/) |
Powered by Discuz! X3.3 |






 看一看
看一看