外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用
标题: 【Cell】肿瘤细胞迫使基质细胞通过外泌体释放无蛋白结合... [打印本页]
作者: Johnny 时间: 2017-7-19 17:30
标题: 【Cell】肿瘤细胞迫使基质细胞通过外泌体释放无蛋白结合...
本帖最后由 Johnny 于 2017-7-19 17:30 编辑
导读:近日,来自宾夕法尼亚大学佩雷尔曼医学院的Andy J. Minn教授在国际著名期刊Cell杂志发表文章,报道了基质细胞释放包含RNA的外泌体,其以无蛋白结合的形式驱动受体乳腺癌细胞中的抗病毒信号,最终导致肿瘤生长以及耐药性。肿瘤领域及外泌体领域大牛、康奈尔大学教授David Lyden在同期针对该研究发表了Leading Edge的Preview。
RN7SL1 RNA
基质成纤维细胞与癌细胞之间的相互作用产生癌症进展、抗药性和炎症反应的信号。尽管作为模式识别受体(PRRs)的损伤相关分子模式(DAMPs)的内源性RNA可能代表一种这样的信号,但这些RNA在非病理状况下的作用尚未被认知。来自宾夕法尼亚大学佩雷尔曼医学院的研究表明,乳腺癌细胞触发基质细胞NOTCH-MYC信号通路导致POL3驱动的RN7SL1增加。RN7SL1是一种通常被RNA结合蛋白SRP9/14结合的内源性RNA。RN7SL1的这种增加改变了其与SRP9/14之间的化学计量比例,并在基质外泌体中产生非屏蔽的RN7SL1(小编注:SRP9/14结合时被称为shielded RN7SL1,被屏蔽的RN7SL1;无SRP9/14结合时被称为unshielded RN7SL1,非屏蔽的RN7SL1)。在外泌体转移到免疫细胞后,非屏蔽的RN7SL1触发炎症反应;转移到乳腺癌细胞后,非屏蔽RN7SL1激活PRR RIG-1以增强肿瘤生长、转移和治疗抗性。通过来自患者肿瘤和血液的证据证实,通过部署RNA DAMPs激活基质细胞与非屏蔽RNA的调控协同促进癌症侵袭性特征。
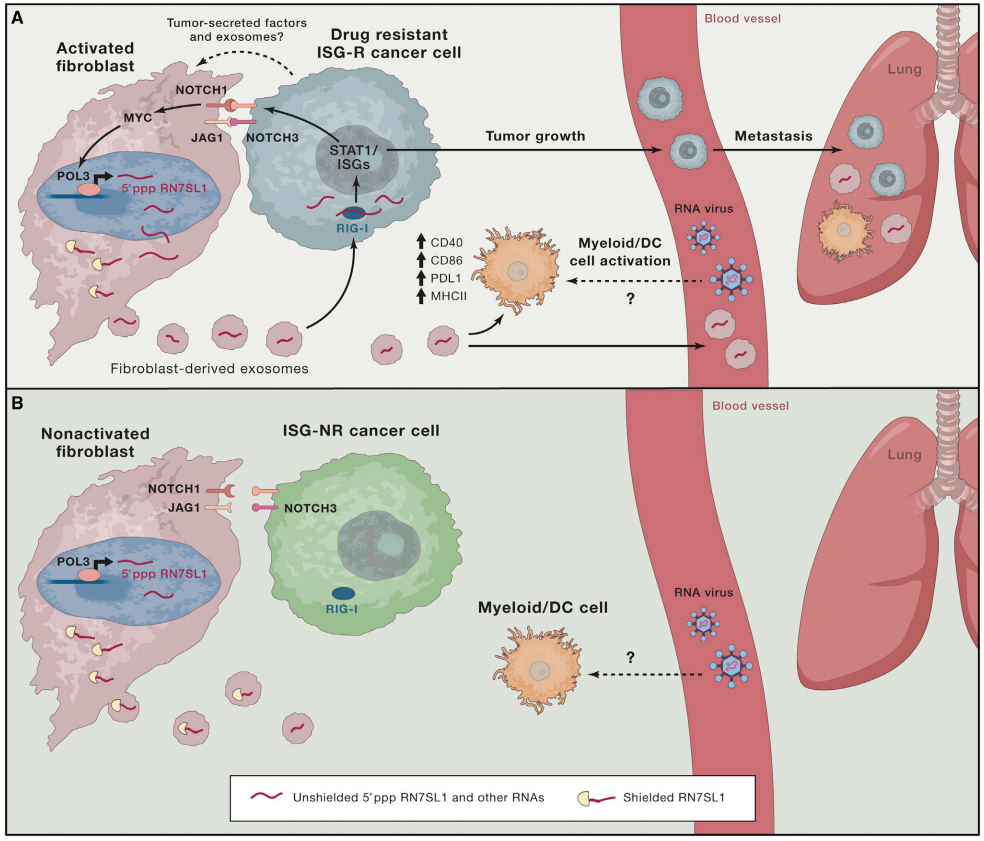
肿瘤和基质细胞之间的相互作用增加了基质细胞外泌体中非屏蔽RN7SL1的含量从而促进炎症、肿瘤生长和转移(A)异型肿瘤间质相互作用诱导乳腺癌细胞亚型中的干扰素刺激基因(ISG)(称为ISG反应器,ISG-R)。癌细胞与基质细胞接触和乳腺癌NOTCH3和基质JAG1接合增加外泌体产生并触发基质NOTCH1-MYC活化。肿瘤细胞是否也释放可溶性因子和外泌体进一步加强相互通讯仍有待确定。基质NOTCH1-MYC信号传导增加RNA聚合酶III(POL3)转录活性,因此增加RN7SL1。RN7SL1水平增加,而SRP9和SRP14没有等比例增加,因此非屏蔽的RN7SL1显著增加。非屏蔽RN7SL1被释放在基质外泌体中并转移到ISG-R乳腺癌细胞中,激活模式识别受体(PRR)RIG-1,导致STAT1激活和ISG诱导。非屏蔽的外泌体核糖核酸RN7SL1也激活骨髓/树突细胞,诱导CD40、CD86、PDL1和MHCII表达。非屏蔽的外泌体RN7SL1和RIG-1激活促进原发性肿瘤生长和转移。有趣的是,病毒颗粒含有内源性非病毒RNA,包括RN7SL1,而不是以类似于乳腺癌外泌体的方式激活RIG-1的SRP。(B)ISG无应答者(ISG-NR)乳腺癌细胞不能增强基质外泌体转移并在肿瘤间质相互作用时诱导ISG。ISG-NRs不增加基质RN7SL1转录或基质外泌体产生。通过SRP9和SRP14结合RN7SL1可抑制RIG-1激活和ISG诱导。
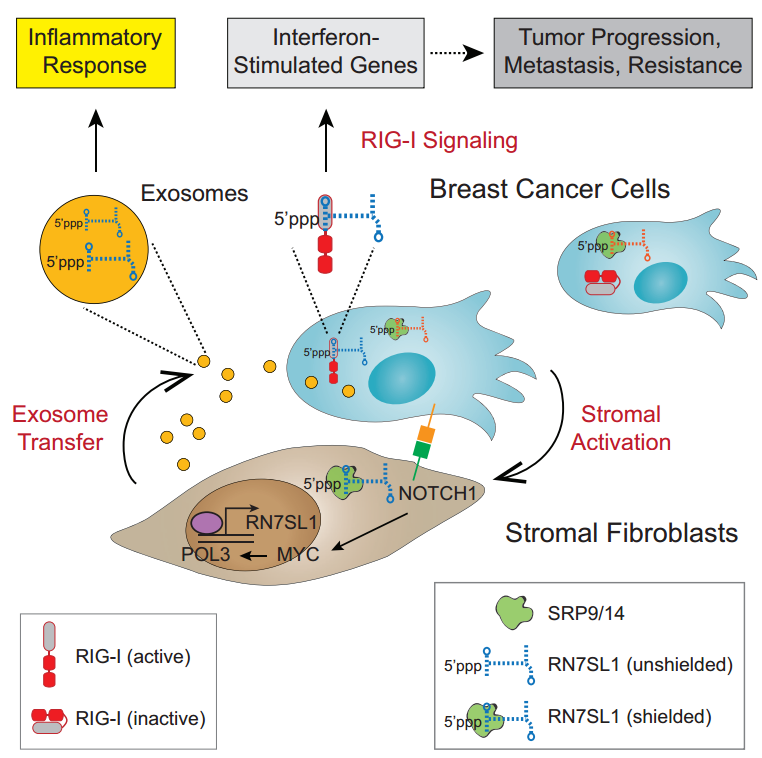 Highlights
Highlights- 胞质RNA被RNA结合蛋白屏蔽从而抑制RIG-I的识别
- 肿瘤成纤维细胞中NOTCH-MYC信号通路促进非屏蔽的RN7SL1 RNA通过外泌体释放
- 外泌体中的非屏蔽RN7SL1作为DAMP 激活乳腺癌的RIG-I
- RNA的非屏蔽与基质激活协同促进炎症和肿瘤进展
该研究通过测试癌症患者的血液发现外泌体内存在非屏蔽的RN7SL1,因此或许能通过检测外泌体非屏蔽RN7SL1鉴定癌症侵袭性更强的患者。另一方面,现在已经知道这种非屏蔽的RNA如何产生如何发挥作用,基于此,或可寻找潜在的治疗靶点。
参考文献:
- Nabet B Y, Qiu Y, Shabason J E, et al. Exosome RNA Unshielding Couples Stromal Activation to Pattern Recognition Receptor Signaling in Cancer[J]. Cell, 2017, 170(2): 352-366. e13. 附件已隐藏,回复该贴可查看附件
- Matei I, Kim H S, Lyden D. Unshielding Exosomal RNA Unleashes Tumor Growth And Metastasis[J]. Cell, 2017, 170(2): 223-225. 附件已隐藏,回复该贴可查看附件
作者: wenshumm5 时间: 2017-7-19 21:56
谢谢!!!!!!!!!!!!
作者: 杨云云 时间: 2017-7-20 08:16
好资料谢谢分享
作者: daijiayong 时间: 2017-7-20 08:24
nice nice nice
作者: dlwlrma 时间: 2017-7-20 10:10
谢谢分享
作者: madanbao 时间: 2017-7-20 14:48
RN7SL1 RNA的非屏蔽与基质激活协同促进炎症和肿瘤进展这个点很新
作者: maomaobainian 时间: 2017-7-20 19:48
谢谢分享
作者: kibana 时间: 2017-7-20 20:50
谢谢。。。。。。。。。。。。。。。。。。。。。。。。。。。。
作者: 卖萌的木耳君 时间: 2017-7-22 15:06
谢谢!!!!!!!!!!!!!!!!!!!!!!!!!
作者: FunkyWoody 时间: 2017-7-24 16:38
Cell二连发,老哥稳
作者: Funleeeeee 时间: 2017-7-24 17:47
很有趣的报道
作者: wangwxl1128 时间: 2017-7-25 16:59
谢谢啦~楼主辛苦!
作者: zZ4869 时间: 2017-7-25 19:30
谢谢!!!!!很感谢
作者: 一土娃何 时间: 2017-8-1 12:16
感谢分享
作者: linzhen41 时间: 2017-8-8 00:07
谢谢分享!
作者: grapetian 时间: 2017-8-10 16:36
谢谢分享 多谢
作者: 于雪110119 时间: 2017-8-16 13:41
谢谢!!!!!!!!!!!!!!!!!!!!!!!11
作者: 发五分上文章 时间: 2017-10-9 17:40
很好的文章
作者: 魔方 时间: 2017-10-19 23:30
肿瘤细胞迫使基质细胞通
作者: lichunning 时间: 2017-11-14 12:27
非常感谢! 好文章
作者: sdnujack 时间: 2018-1-3 10:19
XIEXIEFENXIANG,学习了
作者: 扫尽尘嚣 时间: 2018-1-10 17:22
赞赞赞赞赞赞赞赞赞赞赞
作者: menghuahua 时间: 2018-4-10 14:57
谢谢!!!!!!!!!!!!!!!!!
作者: 故人老 时间: 2018-6-24 18:12
谢谢分享
作者: marshall 时间: 2018-6-30 23:28
感谢分享
作者: Mango1998 时间: 2021-10-5 11:12
谢谢分享
| 欢迎光临 外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用 (http://exosome.com.cn/) |
Powered by Discuz! X3.3 |


 Highlights
Highlights