外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用
标题: Science: 小RNA通过外泌体跨界传输——植物与病原体的军备... [打印本页]
作者: Johnny 时间: 2018-5-29 20:39
标题: Science: 小RNA通过外泌体跨界传输——植物与病原体的军备...
Science: 小RNA通过外泌体跨界传输——植物与病原体的军备竞赛
一些病原体和害虫将小RNAs(sRNAs)递送到宿主细胞中以抑制宿主免疫力。相反,宿主也将sRNAs转移到病原体和害虫中以抑制它们的毒力。尽管在各种相互作用中观察到sRNAs运输,但是sRNAs如何转移,特别是从宿主转移到病原体/害虫,仍然是未知的。美国加州大学河滨分校金海翎教授课题组揭示宿主拟南芥细胞分泌外泌体样细胞外囊泡传递sRNAs至真菌病原体灰霉病菌。这些含sRNAs的囊泡在感染部位积累并被真菌细胞摄取。转移的宿主sRNAs诱导关键致病性真菌基因沉默。因此,在与病原体进化的军备竞赛中,拟南芥将外泌体介导的跨界RNA干扰作为其免疫应答的一部分。
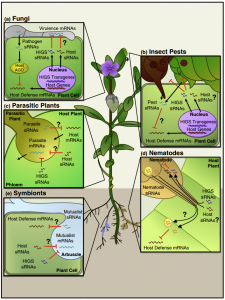
植物与相互作用生物之间的跨界基因沉默
小RNAs(sRNAs)是一种短的调控RNAs,可以用互补序列沉默基因。在动物体内,sRNAs可通过细胞外囊泡、特异性跨膜蛋白、高密度脂蛋白复合物或间隙连接运输。在植物中,sRNAs通过胞间连丝从一个细胞移动到另一个细胞,并通过脉管系统系统地传播。值得注意的是,sRNAs也在宿主和相互作用的生物之间转移并诱导基因沉默,这种现象称为跨界/生物RNA干扰(RNAi)。但是,移动式sRNAs如何跨越不同分类学“界”的生物之间的界限?胃肠寄生虫多形螺旋线虫分泌外泌体,一类胞外囊泡,将microRNAs(miRNAs)转运到哺乳动物细胞中以抑制宿主免疫(Buck, Nat. Commun. 2014)。相反,sRNAs从宿主转运到相互作用的病原体/害虫的机制是完全未知的。
为了研究宿主sRNAs如何进入相互作用的真菌细胞并鉴定植物内源性转移的sRNAs,金教授课题组使用了双向sRNA运输和跨界RNAi的拟南芥灰霉病病原体系统。由于植物和真菌的细胞壁组成不同,他们开发了一种原生质体纯化方法,以从感染组织中分离出纯的真菌细胞。
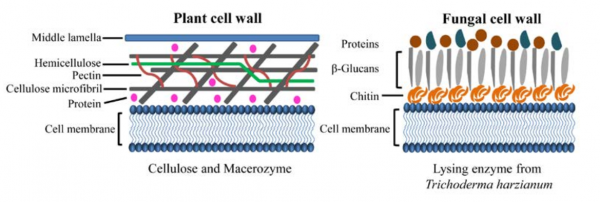
植物和真菌细胞壁的模式图。主要由纤维素、半纤维素、果胶和蛋白质组成的植物细胞壁可以被纤维素和球菌酶消化。
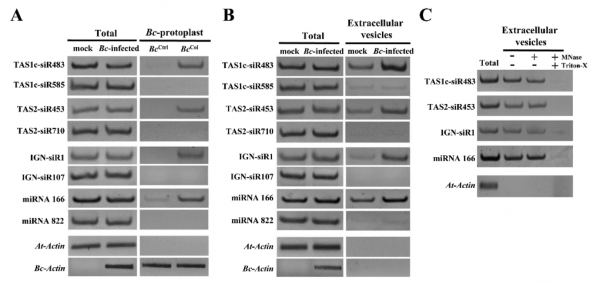
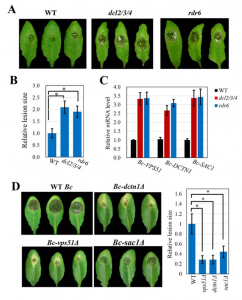
纯化的灰葡萄孢原生质体的sRNA谱分析在所有三个生物学重复中鉴定了42个拟南芥sRNAs,使用每百万总读数的40个标准化读数作为截取点(cutoff)。对拟南芥叶片的总RNA进行sRNA分析作为对照。尽管更多的sRNAs更有可能被转运,但在转移的sRNAs中有明确的选择。在转移的42个拟南芥sRNAs中,25个是低丰度的,并且不在总sRNA文库中的前100个sRNA中。引人注意的是,尽管反式作用的小干扰RNA基因座1C衍生的siRNA483(TAS1c-siR483)与TAS1c-siR585从相同的TAS1c mRNA前体产生,并且都属于总sRNA文库的前20个最丰富的sRNAs,但是在真菌原生质体中,TAS1c-siR483被富集,而TAS1c-siR585没有。类似地,尽管TAS2-siR710在总sRNA文库中的读数比源自相同TAS2前体的TAS2-siR453高30倍,但仅有TAS2-siR453存在于真菌原生质体中。此外,尽管IGN-siR107在总sRNA文库中积累到更高水平,但是源自基因间区域(例如IGN-siR1,但不是IGN-siR107)的拟南芥异染色质sRNA富集于灰葡萄孢菌细胞中。这些结果通过sRNA RT-PCR分析得到验证。因此,将内源性sRNAs转移到真菌细胞中的宿主细胞不是简单地通过浓度依赖性扩散,这可能是一个具有选择性的过程。
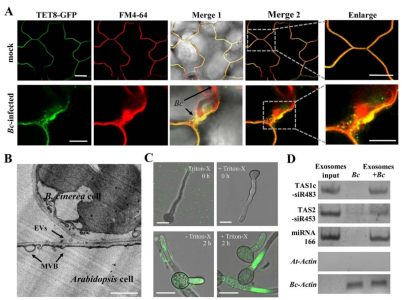
为了测试植物是否分泌囊泡以将sRNAs转移到真菌细胞中,研究人员检测了从感染叶片的细胞外液中分离出的囊泡sRNA。TAS1c-siR483、TAS2-siR453和IGN-SIR1累积水平分别高于TAS1c-siR585、TAS2-siR710和IGN-siR107。这与真菌原生质体结果相似。42个转移的宿主sRNAs中有31个(73.8%)存在于囊泡文库中。这些结果支持来自细胞外囊泡和真菌细胞的sRNAs之间的正相关性。核酸酶保护试验表明转移的宿主sRNAs被保护免于核酸酶消化,除非囊泡被Triton-X-100破坏,证实了转移的sRNAs确实在囊泡内而不是结合到表面。这些发现表明植物细胞分泌细胞外囊泡以将sRNAs转移到真菌细胞中。
植物内源性sRNAs通过细胞外囊泡转移到真菌细胞中
动物细胞外囊泡通过其特定的蛋白质标记和来源被分为外泌体、脱落微泡和凋亡小体,而植物细胞外囊泡仍不明确。由于外泌体参与了在动物细胞和寄生虫H.hypergyrus与其哺乳动物宿主之间的miRNA转移,金教授试图确定植物是否也使用外泌体小泡来转移sRNAs。哺乳动物四跨膜蛋白,如CD63,是特异性外泌体标志物。拟南芥具有17个四次跨膜蛋白TETRASPANIN(TET)样基因,但只有密切相关的TET8和TET9由B.Cinerea感染诱导。TET8和TET9在结构上与哺乳动物CD63相似。
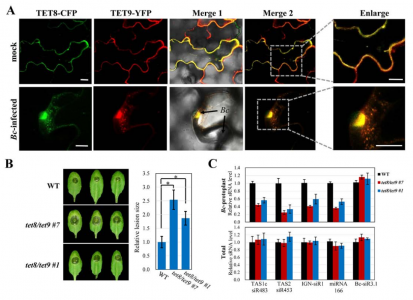
随后进一步实验证明了,植物内源性sRNAs是通过四次跨膜蛋白相关的外泌体传递到病原体的,并且TET8和TET9共同调控了sRNA的分泌和宿主免疫。这些被转运进病原体的sRNAs沉默真菌毒力基因并抑制真菌致病性。
Tetraspanin相关的外泌体将植物sRNAs转移至真菌细胞
TET8和TET9协同调节sRNA分泌和宿主免疫
转移的宿主sRNA沉默真菌毒力基因并抑制真菌致病性
总结一下,这项研究报道了,植物细胞外囊泡,特别是外泌体,在拟南芥与真菌病原体B.cinerea之间的跨界sRNA运输中发挥重要作用。拟南芥分泌外泌体将宿主sRNAs输送到真菌细胞中以沉默毒力相关基因。在人体中可以看到一个有趣的现象:将人miRNAs跨界转移进入寄生虫恶性疟原虫抑制其致病基因,这就解释了为什么镰状细胞性贫血患者转移miRNAs升高更能抵抗疟疾。目前还不清楚人类外泌体是否也负责sRNA的输送,以及在动植物中是否普遍存在这种sRNA转移介导的防御机制。宿主转移的sRNA的功能研究将有助于鉴定相互作用的病原体和害虫中的重要毒力基因。此外,转基因衍生的sRNAs也通过细胞外囊泡递送到真菌细胞中。在跨界RNAi中发现外泌体功能可能有助于开发有效的病原体靶向的人工RNAs的递送方法,对控制各种收获前和收获后作物中的植物病害将发挥重要帮助。
通讯作者简介:
金海翎博士,1991年于武汉大学获得生物学学士学位,1996年获得上海植物生理研究所分子遗传学博士学位,现为加州大学河边分校教授。金海翎博士对植物内源小分子RNA产生过程及其生物学功能进行了大量的研究工作,研究成果有望揭示植物免疫及小分子RNA调控过程中新的调节机制。
参考文献:
- H. Buck, G. Coakley, F. Simbari, H. J. McSorley, J.F. Quintana, T. Le Bihan, S. Kumar, C. Abreu-Goodger, M. Lear, Y. Harcus, A.Ceroni, S. A. Babayan, M. Blaxter, A. Ivens, R. M. Maizels, Exosomes secretedby nematode parasites transfer small RNAs to mammalian cells and modulateinnate immunity. Nat. Commun. 5, 5488 (2014). doi:10.1038/ncomms6488Medline
- Cai Q, Qiao L, Wang M, He B, Lin FM, Palmquist J,Huang HD, Jin H. Plants send small RNAs in extracellular vesicles to fungalpathogen to silence virulence genes. Science. 2018 May 17. pii:eaar4142. doi: 10.1126/science.aar4142. [Epub ahead of print]
| 欢迎光临 外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用 (http://exosome.com.cn/) |
Powered by Discuz! X3.3 |