外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用
标题: Cell: 抑制外泌体PD-L1的分泌有助于肿瘤免疫治疗 [打印本页]
作者: Johnny 时间: 2019-4-6 16:26
标题: Cell: 抑制外泌体PD-L1的分泌有助于肿瘤免疫治疗
本帖最后由 Johnny 于 2019-4-6 16:26 编辑
Cell大发现丨抑制外泌体PD-L1的分泌有助于肿瘤免疫治疗
肿瘤细胞表面的PD-L1结合效应T细胞上的PD-1受体,从而抑制T细胞活性。PD-L1抗体可以阻断该过程,激活抗肿瘤免疫应答,实现肿瘤肿瘤。近日,来自加州大学旧金山分校(University of California, San Francisco)的研究人员在Cell杂志上发表文章,发现肿瘤来源的外泌体上的PD-L1也参与了肿瘤细胞的免疫治疗逃避。重要的是,对于一些PD-L1抗体治疗效果不佳的肿瘤类型,通过抑制外泌体PD-L1分泌并同时进行PD-L1抗体治疗,能够实现良好的抗肿瘤免疫治疗。
免疫治疗彻底改变了传统的肿瘤治疗方法。目前针对免疫检查点蛋白的抑制剂有PD-L1(又名CD274)抗体和PD-1(又名PDCD1)抗体,已经发现PD-L1抗体和PD-1抗体对很多肿瘤类型有效,包括黑色素瘤、非小细胞肺癌和肾癌等。通过这些免疫治疗方法,许多患者的肿瘤生长得到了持久缓解,而且这些患者通常在此前已经尝试过多种其他治疗策略但是已失败告终。然而,即使在这些已经使用免疫治疗很成熟的肿瘤类型里,只有10%-30%的患者对PD-L1 / PD-1抗体治疗有显著疗效。在其他一些肿瘤类型中,例如前列腺癌,肿瘤细胞对免疫治疗反应很小。因此,不同肿瘤患者之间、不同的肿瘤类型之间对免疫治疗的敏感性存在很大差异,而这其中的机制尚未得到过清晰的研究。
PD-L1是在许多细胞类型的细胞表面上存在的膜结合配体,其在炎症和许多致癌病变的条件下被上调。PD-L1配体会结合T细胞上的PD-1受体,导致Sh2p驱动的T细胞受体及其共同受体CD28的去磷酸化,从而抑制抗原驱动的T细胞活化。通过PD-L1介导的这个通路控制着炎症反应,PD-L1基因敲除小鼠会产生类似自身免疫性疾病。然而,肿瘤细胞可以通过PD-L1介导的逃逸机制来逃避免疫监视和免疫细胞的杀伤。 PD-L1和PD-1的治疗性抗体可以阻断二者的相互作用,重新激活抗肿瘤免疫应答,这便是肿瘤免疫治疗的基础理论。
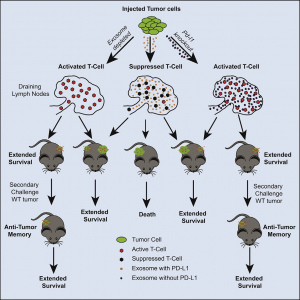
通常认为PD-L1在肿瘤床内发挥作用,肿瘤细胞表面PD-L1与肿瘤浸润淋巴细胞(TIL)表面上的PD-1直接相互作用。令人惊喜的是,PD-L1也可以在细胞外囊泡(EV)的表面上存在,并且EV表面的PD-L1水平与肿瘤进展密切相关。然而,细胞外的PD-L1是否可通过诱导局部或全身免疫抑制来促进肿瘤进展尚不清楚。EV是一种异质的囊泡,其中一种类型叫做外泌体,外泌体源自细胞的胞吞途径。随着胞内体的成熟,囊泡在胞内体中萌芽并在内腔中释放,形成晚期胞内体中的囊泡内体(intravesicular bodies)。这些晚期内体也被称为多泡体(MVB)。MVB可以与溶酶体融合,将其中的内容物降解或吸收,也可以与质膜融合,向细胞外释放囊泡体,也就是外泌体。外泌体可以根据其大小、形态、密度、标记物表达以及对其生物发生的特定酶的依赖性的不同而与其他EV类型区分开。外泌体生物发生的关键酶包括NSMASE2(又称SMPD3)和RAB27A,SMPD3促进囊泡内体的萌芽,RAB27A参与MVB与质膜的融合。因此,通过对这些酶调控可实现对外泌体在体内作用的干预。
研究人员对不同肿瘤的PD-L1调节机制进行研究时发现,肿瘤细胞在大多数情况下是通过外泌体分泌PD-L1,而不是直接在细胞表面上呈递PD-L1。通过对Rab27a和nSMase2进行基因敲除以及从外源引入的外泌体方式,研究人员发现来自肿瘤细胞的外泌体PD-L1以免疫依赖的方式促进肿瘤生长。体内外实验方向,外泌体PD-L1在引流淋巴结处抑制T细胞功能。外泌体PD-L1能够促进PD-L1抗体治疗的耐受性,在PD-L1抗体治疗无效的前列腺癌中,PD-L1和外泌体促进前列腺癌细胞生长。值得注意的是,短期存在的外泌体PD-L1缺陷也会导致长期全身性的抗肿瘤免疫。外泌体PD-L1的这种作用在结直肠癌模型中也被证实。在结直肠癌中,PD-L1抗体与外泌体PD-L1分泌的抑制可共同实现肿瘤抑制效果。因此,外泌体PD-L1是一种新的免疫治疗靶点,可以解决目前PD-L1抗体治疗存在的耐受性问题。
参考文献:Mauro Poggio et al. Suppression of exosomal PD-L1 induces systemic anti-tumor immunity and memory. Cell 2019, 177, 414–427, April 4.
附件已隐藏,回复该贴可查看附件
作者: tanzixun101265 时间: 2019-4-7 11:04
666666666666666666666666666666666666666666666
作者: zyy 时间: 2019-4-7 14:55
谢谢分享
作者: zyy 时间: 2019-4-7 14:56
谢谢楼主分享,点赞
作者: 小彭要去种蘑菇 时间: 2019-4-7 18:28
谢谢楼主分享
作者: muzi1987xiaohao 时间: 2019-4-8 08:49
感谢分享
作者: 生物小博 时间: 2019-4-8 13:24
很好的文章 可以学习下
作者: NJUPT_xuyu 时间: 2019-4-10 10:31
研究外泌体的有群吗,感觉可以建一个
作者: 一步之遥 时间: 2019-4-10 11:28
楼主一生平安
作者: 玉辇龙章 时间: 2019-4-11 08:42
牛逼了,,这个真是牛逼了,谢谢分享
作者: wdl 时间: 2019-4-16 10:24
嗡嗡嗡企鹅阿三
作者: 忽然天晴 时间: 2019-4-20 10:30
感谢分享 笔芯(^-^)V
作者: kyosauka 时间: 2019-4-25 15:12
谢谢大神
作者: Edison_yang1 时间: 2019-5-8 13:58
谢谢分享
作者: zhangxuan 时间: 2019-5-8 16:24
感谢分享
作者: 花要光 时间: 2019-5-11 10:35
感谢分享
作者: cystrr 时间: 2019-5-23 16:43
看看附件内容
作者: 外小白 时间: 2019-6-16 22:57
xixiexiefenxiang
作者: 寻尘 时间: 2019-6-17 09:38
谢谢分享
作者: LZD 时间: 2019-6-17 21:58
谢谢大佬
作者: 13533656842 时间: 2019-6-20 16:00
Suppression of exosomal PD-L1 induces systemic anti-tumor immunity and memory全文
作者: Miss.Gao 时间: 2019-7-3 09:36
谢谢楼主分享
作者: zmzhang2008 时间: 2019-7-10 09:04
谢谢,下载下来,仔细阅读。
作者: JCai 时间: 2019-7-23 17:13
最近开始关注外泌体的PD-L1,感谢版主的分享
作者: celilia 时间: 2019-8-9 16:16
好厉害,要保存文献。
作者: lsy0207 时间: 2020-2-18 15:08
感谢分享
作者: hency 时间: 2020-2-20 10:04
66666666666666
作者: 孙晓东 时间: 2020-4-25 21:41
谢谢分享!
作者: starry 时间: 2020-4-26 00:23
感谢分享
作者: zydmm118 时间: 2020-9-8 11:22
学习了~~
| 欢迎光临 外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用 (http://exosome.com.cn/) |
Powered by Discuz! X3.3 |