外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用
标题: Nature子刊:间日疟原虫患者血浆EVs促进寄生虫的脾脏粘附 [打印本页]
作者: Johnny 时间: 2020-6-14 15:29
标题: Nature子刊:间日疟原虫患者血浆EVs促进寄生虫的脾脏粘附
Nature子刊:间日疟原虫患者血浆EVs通过NF-κB促进寄生虫的脾脏粘附间日疟原虫(Plasmodium vivax)属于孢子纲。由按蚊传播。子孢子在按蚊体内形成之后,随蚊唾液注入人体。先进入人体肝脏,并在肝细胞内繁殖,后移入血液,在红血细胞内繁殖。间日疟原虫引起的疟疾是非洲大陆以外最普遍的疾病形式,每年造成750万例病例,可能导致严重的症状甚至死亡。
间日疟原虫感染的谜团之一是尽管血液中寄生虫水平低,但它仍可引起严重症状。最近的研究表明,这可能是由于寄生虫“隐藏”在脾脏中。
细胞外囊泡(EVs)是由活细胞分泌的多种细胞衍生膜结构,存在于包括血浆在内的生物体液中,并参与病理过程。EVs由于其在细胞间通讯中的作用及其作为疾病的治疗剂和非侵入性生物标志物的转化潜力,因此吸引了科学关注。作为细胞间的物质和信息传播者,有研究表明它们在包括寄生虫病在内的各种病理学中发挥作用。在最致命的寄生虫病-恶性疟疾的特殊情况下,循环EVs与脑型疟疾的严重程度相关。
此外,来自体外培养的被感染的红细胞(iRBCs)的EVs诱导了配子体的形成,配子体是导致疟疾传播的重要阶段。其他研究表明,EVs中含有能够触发寄生虫毒力、调控内皮细胞屏障特性和调节免疫应答的信号传导机制的核酸。这些结果表明,来自恶性疟原虫体外培养或啮齿类疟疾模型中实验性感染的EVs携带寄生虫成分作为细胞间的传播者。然而,尚未报道由自然人疟疾寄生虫感染引起的循环EVs与病理学的直接联系。
恶性疟原虫引起的人类疟疾病理学主要归因于成熟的寄生虫iRBC在其表面表达粘附性变异蛋白(统称为红细胞膜蛋白1);并在不同器官的微脉管系统中向内皮细胞受体粘附,尤其是细胞间粘附分子(ICAM-1)。此外,恶性疟原虫-iRBCs及其分泌产物可诱导与NF-kB转录因子核易位相关的脑内皮细胞ICAM-1表达。恶性疟原虫的体外培养系统促进了这些研究,从该系统中可以获取无限量的寄生虫iRBC,用于粘附实验。
就间日疟原虫而言,它是分布最广泛的人类疟疾寄生虫,因此没有强大的体外培养系统。然而,已证明患者来源的间日疟原虫iRBCs粘附于内皮细胞和胎盘糖胺聚糖。间日疟原虫iRBCs表达变异表面蛋白VIR17,与ICAM-1受体结合。此外,使用网织红细胞倾向的、非致死性啮齿动物疟疾模型(类似于间日疟原虫)的体内研究表明,iRBC对红髓中的成纤维细胞来源的脾屏障细胞具有积极的细胞粘附作用。此外,在间日疟原虫患者脾脏破裂的临床病例中,在间日疟原虫感染期间脾脏中iRBC积累的现象,以及在实验性感染间日疟原虫的猴子的组织病理学研究中也观察到此现象。这些研究进一步支持了间日疟原虫iRBCs在脾脏中的聚集的假设。
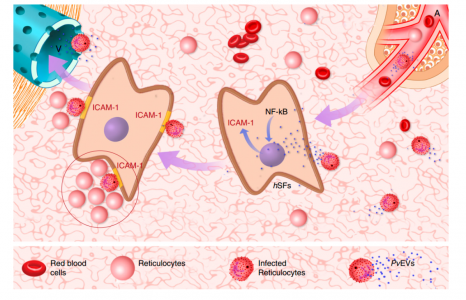
该研究假设间日疟原虫患者血浆中循环的EV(PvEVs)包含寄生虫蛋白,并向人类脾脏成纤维细胞发出信号,促进感染的网织红细胞的粘附。研究结果表明,患者血浆来源的EV含有寄生虫蛋白,并且被人脾成纤维细胞(hSFs)特异性摄取,从而诱导与NF-kB核易位相关的ICAM-1上调。当hSFs吸收PvEVs时,来自患者的间日疟原虫感染的网织红细胞显示出特定的粘附特性,这是通过抑制NF-kB转运至细胞核而逆转的。这些数据共同为人类疟疾病理机制提供了基于生理EV的见解,并支持了人类脾脏微脉管系统中间日疟原虫粘附的寄生虫亚群的存在。
EVs在间日疟原虫中的生理作用的脾脏模型。来自受感染细胞的循环血浆来源的细胞外囊泡(PvEV)进入脾脏的微脉管系统,并被人脾成纤维细胞(hSF)摄取。此事件发信号通知NF-kB易位至细胞核和ICAM-1的转录。在ICAM-1翻译并在hSF表面表达后,感染的网织红细胞在富含网织红细胞的生态位(带圆圈)中与这些细胞结合,寄生虫可以侵入并繁殖。
参考文献:
Haruka Toda et al. Plasma-derived extracellular vesicles from Plasmodium vivax patients signal spleen fibroblasts via NF-kB facilitating parasite cytoadherence. Nature Communications 2020 Jun 2;11(1):2761.
| 欢迎光临 外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用 (http://exosome.com.cn/) |
Powered by Discuz! X3.3 |