外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用
标题: 心肌球外泌体miRNA参与小儿扩张型心肌病心肌修复 [打印本页]
作者: Johnny 时间: 2020-12-19 16:27
标题: 心肌球外泌体miRNA参与小儿扩张型心肌病心肌修复
本帖最后由 Johnny 于 2020-12-19 16:27 编辑
Science子刊:心肌球外泌体miRNA参与小儿扩张型心肌病心肌修复
近日,Science Translational Medicine杂志(影响因子16.264)上的一篇文章报道了心机球细胞及其外泌体在儿童扩张型心肌病(DCM)猪模型中安全性和疗效,并在初步临床试验中验证了其安全性。还揭示了心肌球细胞外泌体miRNA参与心脏修复的作用机制。
儿童扩张型心肌病(DCM)是小儿心肌病的最常见形式,可能表现为多种获得性和遗传性疾病。尽管儿童期原发性DCM的年发病率较低,但死亡或心脏移植的5年无事件生存率为50%至60%。由于小样本量少,由于缺乏合适的实验模型和足够的统计能力来验证终点,因此对小儿DCM患者心力衰竭治疗的临床前和临床研究受到了限制,因此很少开发药物治疗和非药物干预措施来降低晚期心力衰竭儿童的死亡率。
利用干细胞来减轻先天性心脏病(CHD)引起的心室功能的逐渐降低的潜在兴趣已引起广泛关注。近年来,各种干细胞的动员和直接递送扩大了心肌修复的可能性,以治疗包括DCM在内的CHD儿童。但是,很少有使用前瞻性对照试验进行的研究。在儿科人群中使用的各种类型的干细胞中,已证明在单心室病变的儿童中,分期行外科手术姑息治疗对冠状动脉内心肌球来源的细胞(CDC)的递送具有功能性益处。
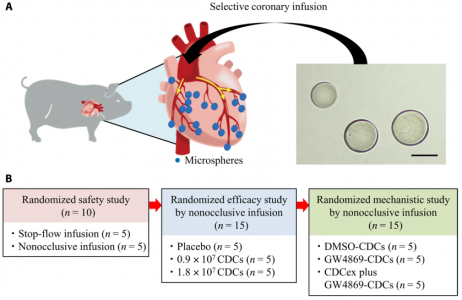
CDC起源于心脏内,并表现出异质性,以形成由克隆衍生细胞组成的多细胞簇。团队来自前瞻性1期对照研究TICAP(单心室生理学经冠状动脉灌注祖细胞)和2期随机对照试验PERSEUS(治疗单心室心脏病的心脏祖细胞灌注)的初步结果证实了CDC输注对结构性心脏病患者的安全性和疗效,以及随后的长期队列研究证明对改善心功能和临床结局具有良好的影响。最近的一项随机试验表明,冠状动脉内同种异体CDC对患有神经肌肉疾病的青少年可能具有有益的作用。鉴于儿童与成人观察到的与CDC递送相关的不同反应,结局可能取决于疾病和CDC的年龄相关的再生潜能,主要通过其分泌的细胞外囊泡介导。小儿DCM患者是否可以从CDC治疗中获益尚不清楚。
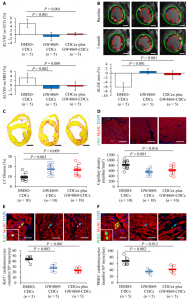
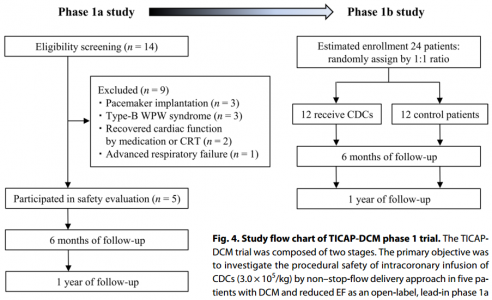
该研究通过冠状动脉微栓塞建立了具有扩张的左心室(LV)和整体收缩功能障碍的猪模型,以概括DCM的结构和功能表型。作为随机剂量递增研究的一部分,该临床前模型有助于评估猪CDC的非闭塞性经冠状动脉输注的安全性和治疗效果。结果表明,CDCs的外泌体分泌的阻断降低了CDCs治疗的益处,CDCs可以改善心脏功能,例如心肌细胞增殖、增强血管生成和减少心肌纤维化。在这些临床前研究的基础上,对患有DCM和射血分数降低(EF)的儿童进行了前瞻性1a期冠状动脉内CDC输注研究。
实验设计
猪DCM模型中CDC外泌体介导的心脏修复
TICAP-DCM临床1期试验流程图
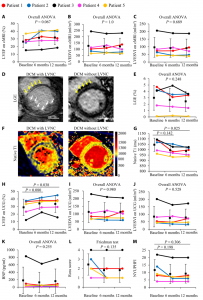
TICAP-DCM1a期试验的心脏功能分析和心力衰竭状态
遏制心肌病
已经研究了干细胞和外泌体作为心血管应用的潜在治疗方法,并取得了不同程度的成功。该研究用心肌球细胞(CDC)或经过预处理以抑制其外泌体释放的CDC来治疗扩张型心肌病的猪模型。注射CDC可实现心脏修复,但阻断外泌体释放会抑制其保护功能,即使外泌体与细胞同时注射也是如此。进入临床后,用CDC安全地治疗了5例扩张型心肌病的小儿患者。对患者CDC衍生的外泌体的分析表明,miR-146a-5p可以抑制炎症细胞因子的表达。结果证明了CDC治疗的安全性,并强调了治疗功效的潜在机制。
摘要
该研究旨在确定DCM猪模型中CDC的安全性和有效性,并将临床前结果转化到临床。使用冠状动脉内注射微球(会导致心脏功能障碍)的DCM猪模型。临床前对40头猪进行了递送方法和CDC剂量的随机验证,并对CDC分泌的外泌体(CDCex)介导的心脏修复进行了分析。临床1期安全性队列招募了5名患DCM且射血分数降低的小儿患者以接受CDC输液。主要终点是评估安全性,次要终点指标是心脏功能的改变。与安慰剂相比,用CDC治疗的动物的心脏功能改善,心肌纤维化减少。这些功能优势是通过CDCex介导的,CDCex富含促血管生成和心脏保护性miRNA,而分离的CDCex并未概括这些修复作用。安全lead-in阶段的一年随访已经完成,并获得了良好的评价和初步的疗效结果。通过抑制促炎细胞因子和转录本,CDCex miR-146a-5p与心肌纤维化减少有关。总的来说,在DCM的猪模型中,冠状动脉内CDC给药是安全的,并且可以通过CDCex改善心脏功能。患者的安全性lead-in结果为进一步研究随机试验和CDCex衍生的miRNAs作为潜在的旁分泌介导物提供了转化框架,该潜在的旁分泌介质是该治疗策略的基础。
参考文献:
HiraiK, Ousaka D, Fukushima Y, Kondo M, Eitoku T, Shigemitsu Y, Hara M, Baba K,Iwasaki T, Kasahara S, Ohtsuki S, Oh H. Cardiosphere-derived exosomal microRNAsfor myocardial repair in pediatric dilated cardiomyopathy. Sci TranslMed. 2020 Dec 9;12(573):eabb3336. PMID: 33298561.
附件已隐藏,回复该贴可查看附件
作者: mangosky 时间: 2020-12-21 10:52
谢谢分享
作者: 阿繄炒小鸡 时间: 2021-1-18 21:34
感谢感谢,谢谢楼主分享!!
| 欢迎光临 外泌体之家 | 细胞外膜泡领域核心平台—exosomes & microvesicles—小膜泡大作用 (http://exosome.com.cn/) |
Powered by Discuz! X3.3 |