|
|
ALIX通过控制EGFR活性和PD-L1呈递来调节肿瘤介导的免疫抑制
| 内容概要:英国伦敦大学国王学院的研究人员Monypenny等人最新在Cell Reports杂志发表文章,报道了ESCRT相关蛋白ALIX调节乳腺癌中两个重要的蛋白质,即,EGFR(一种与细胞存活相关的受体)和PD-L1(一种免疫检查点蛋白)。因此,ALIX与驱动肿瘤生存的细胞自主和非细胞自主机制的途径相关,可能为乳腺癌提供诊断和治疗靶点。 |
表皮生长因子受体(EGFR)在多种癌症中表达上调或突变,并且对肿瘤发生有显著贡献。基底样乳腺癌(BLBC)是治疗结果最差的疾病亚型,通常表现出EGFR表达升高。基于大量的研究,肿瘤EGFR信号网络的复杂性和可塑性可能是当前EGFR靶向治疗效果不佳的原因。因此,需要寻找用于改善基底样疾病中EGFR靶向的其他分子靶标。
免疫检查点阻断为靶向癌症治疗领域抑制肿瘤生长引入了令人兴奋的可能性,利用程序性死亡配体1(PD-L1)显示出巨大的治疗前景。最近证实激活EGFR突变与非小细胞肺癌中PD-L1表达增加之间存在直接关联,这表明癌细胞自主(EGFR依赖性细胞存活)与非自主性(PD-L1依赖性免疫监视的逃避)肿瘤存活的机制之间存在相互依存关系。因此,具有激活EGFR突变的肿瘤受益于两种不同但相关的存活途径,并且突变EGFR的靶向可损害这些肿瘤的免疫抑制表型。然而,在人肺癌细胞系中靶向野生型受体对PD-L1表达几乎没有影响,表明EGFR和PD-L1表达之间的联系依赖于受体激酶活性。在BLBC中,经常观察到PD-L1表达与野生型EGFR表达升高一致,表明靶向EGFR激酶活性的治疗可能对这些肿瘤的免疫抑制特征不起作用。因此,有必要更好地理解驱动乳腺癌中EGFR信号传导的机制;特别是,该疾病中的EGFR活性如何影响由PD-L1介导的免疫抑制途径。
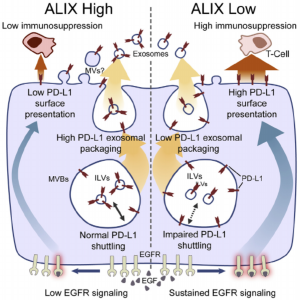
来自英国伦敦大学国王学院的研究人员在BLBC细胞中进行了生物信息学引导的RNAi筛选,以鉴定EGFR活性的调节剂。鉴定的蛋白质是外泌体成分蛋白和涉及外泌体生物发生的蛋白质。细胞中内体分选复合物(ESCRT)的运输所需的组分ALIX是外泌体生物发生的关键介质,他们发现缺乏ALIX显示出增强的EGFR活化,表明外泌体生物发生机制与EGFR活性调节之间的意外相关性。他们发现PD-L1以ALIX依赖性方式分泌在外泌体上,并且外泌体释放受损赋予肿瘤细胞增强的免疫抑制表型,其依赖于EGFR激酶活性。数据表明,ALIX的下调增强EGFR活性和PD-L1介导的BLBC中抗肿瘤免疫逃避的机制,驱动肿瘤存活的细胞自主和非细胞自主机制。
研究摘要
研究显示免疫抑制性跨膜蛋白PD-L1通过多泡体(MVB)传播并在外泌体上释放。高通量siRNA筛选鉴定了转运所需的内体分选复合物(ESCRT)相关蛋白ALIX作为基底样乳腺癌(BLBC)细胞中EGFR活性和PD-L1表面呈递的调节剂。ALIX敲除导致刺激诱导的EGFR活性延长和增强,以及通过MVB的PD-L1运输缺陷,外泌体分泌减少及其向细胞表面的重新分布。增加的表面PD-L1表达赋予ALIX敲除细胞EGFR依赖性免疫抑制表型。在人乳腺癌组织中观察到ALIX和PD-L1表达之间的反向关联,而乳腺癌的免疫活性小鼠模型显示ALIX缺陷的肿瘤更大并且显示出增加的免疫抑制环境。这些数据表明ALIX通过调节PD-L1和EGFR调节免疫抑制,因此可能为BLBC提供诊断和治疗靶点。
亮点:
- ALIX调节乳腺癌细胞中EGFR活性和PD-L1表面呈递
- PD-L1被包装到乳腺癌细胞的外泌体中
- ALIX敲除导致外泌体减少和表面PD-L1表达增加
- 增加的表面PD-L1与增强的免疫抑制表型相关
参考文献:
Monypenny J, Milewicz H, et al. ALIX Regulates Tumor-Mediated Immunosuppression by Controlling EGFR Activity and PD-L1 Presentation. Cell Rep. 2018 Jul 17;24(3):630-641. doi: 10.1016/j.celrep.2018.06.066.
|
|
 /1
/1 
 |Archiver|手机版|外泌体之家 | exosomes & microvesicles
|Archiver|手机版|外泌体之家 | exosomes & microvesicles
