Mol Cancer【IF:10.679】天津医科大学巴一、应国光教授最新研究揭示成纤维细胞外泌体与癌细胞铁死亡的关系
细胞死亡受复杂的细胞内和细胞外信号严格调节,对于各种生物过程至关重要。 铁死亡是一种调节细胞死亡的新形式,涉及铁依赖性脂质过氧化物(lipid-ROS)的积累,并导致细胞的致死性损伤。 最近的一些研究已经确定了铁死亡在介导某些肿瘤发展和耐药性中的重要作用,但人们对其详细的分子机制仍知之甚少。同样,肿瘤相关成纤维细胞(CAF)通过分泌各种生物活性物质来促进肿瘤的进展和耐药性。CAF在调节脂类代谢以及癌细胞的铁死亡中的机制尚不清楚。最新的一篇发表在Molecular Cancer上的研究发现铁死亡在胃癌(GC)中显著抑制,从而促进了肿瘤的生长并降低了对顺铂和紫杉醇的化疗敏感性。通过质谱分析GC癌与癌旁组织中与铁死亡相关基因,确定了与铁死亡密切相关的蛋白花生四烯酸脂加氧酶15(ALOX15)。ALOX15是GC细胞中lipid-ROS产生的主要介质,其表达明显下调,并且与抑制铁死亡密切相关。研究表明CAF分泌的外泌体miR-522在调节GC细胞中ALOX15的表达中起主要作用。同时,泛素特异性蛋白酶7(USP7)促进miRNA分拣相关蛋白hnRNPA1的去泛素化,把miR-522分选进入外泌体CAFs。 因此,这项研究揭示了由外泌体调节癌细胞铁死亡的新机制,并为提高胃癌化疗敏感性提供了新方法。
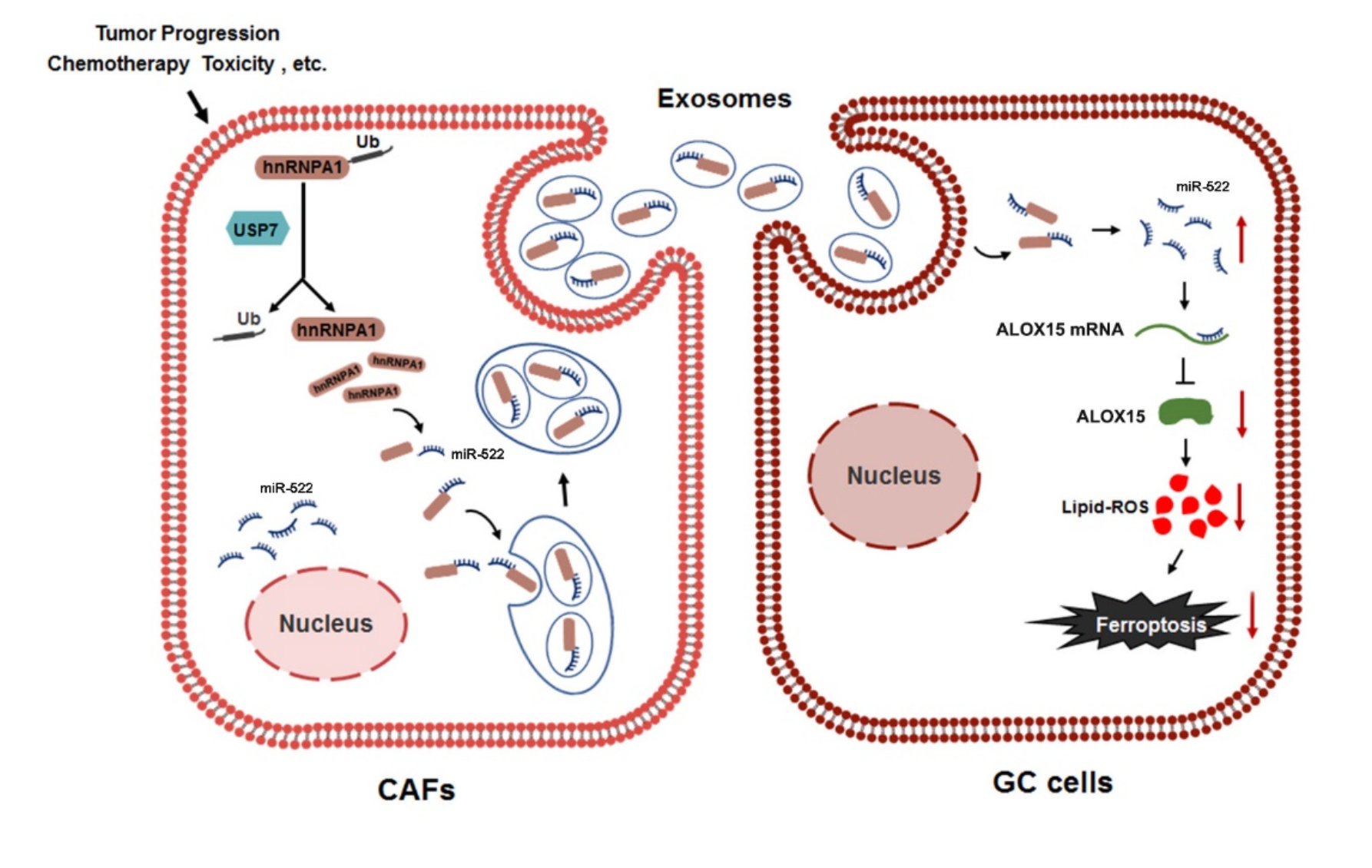
CAFs来源的外泌体miRNA调控ALOX15从而抑制GC细胞铁死亡
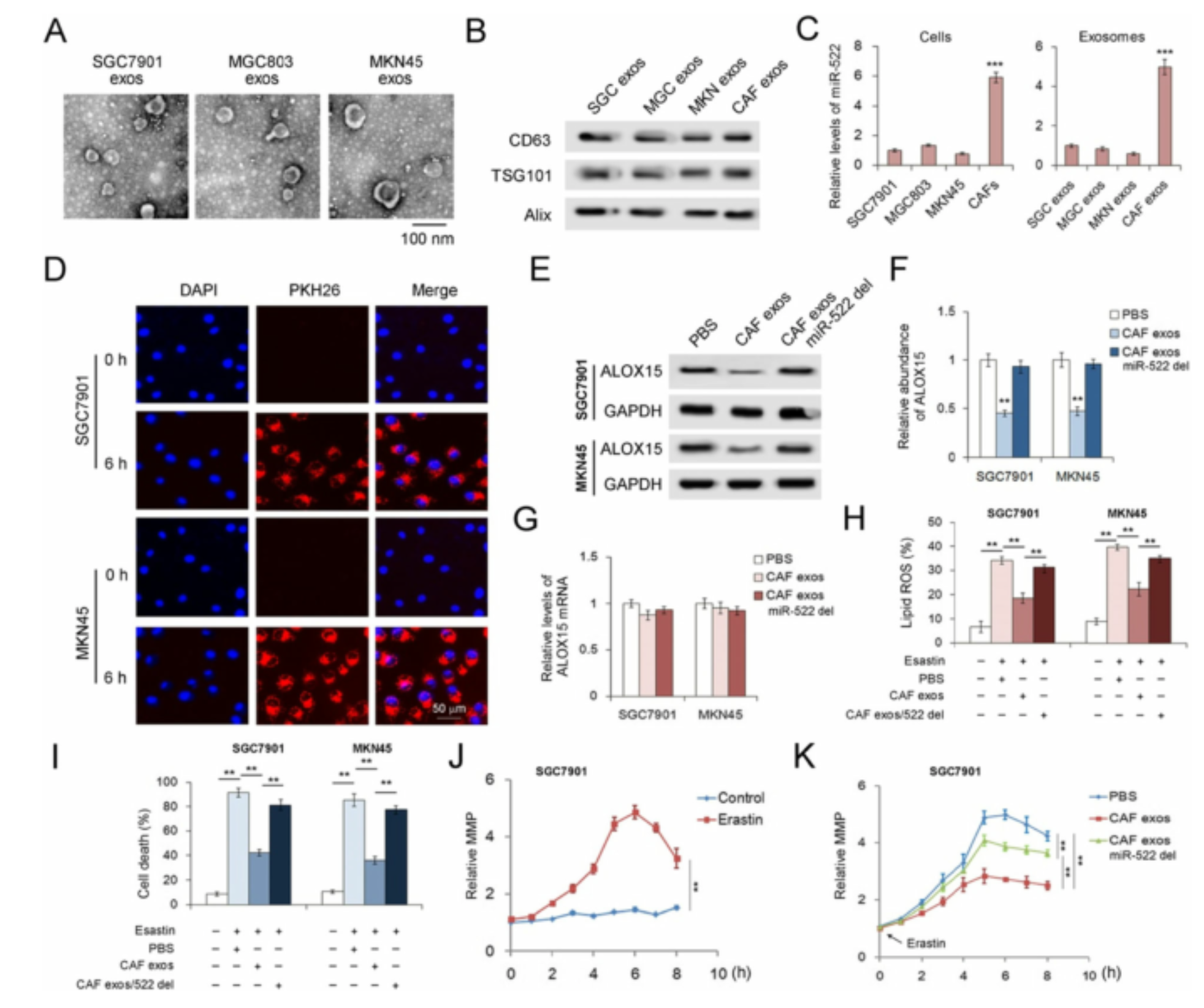
为了研究源自CAF的exo-miR-522在调节癌细胞的铁死亡中的功能,分离了CAF外泌体并与人胃癌细胞系共培养。CAFs中miR-522的量是GC细胞系的6倍,并且在外泌体中观察到了相同的趋势。将CAF外泌体与GC细胞共培养,并在6h时在SGC7901细胞和MKN45细胞中均检测到PKH-26标记的CAF外泌体,这表明源自CAF的外泌体可以有效地与GC细胞融合。同时检测GC细胞中ALOX15 mRNA的含量和ALOX15蛋白的表达,CAF外泌体可显着抑制GC细胞中ALOX15的表达而不会影响依赖miR-522的ALOX15 mRNA的含量。此外,用Erastin处理SGC7901细胞显示出明显的线粒体膜电位(MMP)升高,而加入CAF外泌体部分逆转了Erastin对线粒体的损伤。总而言之,CAF分泌的exo-miR-522抑制了ALOX15的表达并下调了GC细胞中铁死亡的水平。
USP7促进hnRNPA1去泛素化使miR-522分选进入CAFs外泌体
之前已经有报道说hnRNPA家族与非编码RNA分选有关。为了进一步研究USP7,hnRNPA1和miR-522之间的内部联系,作者构建了包含hnRNPA1或USP7编码序列以及两个基因的siR- NAs。质粒转染显著上调hnRNPA1和USP7的表达,而siRNA的转染导致这两个基因的表达显著降低,hnRNPA1或USP7的过表达促进了miR-522包装到外泌体中。然而,两个基因的敲除相对降低了exo-miR-522的水平。Rescue实验表明,过表达的hnRNPA1或USP7部分中和了各自的siRNA对exo-miR-522的影响。接下来,通过使用抗hnRNPA1抗体在免疫沉淀测定的产物中检测到USP7,反之亦然。这些结果表明,USP7使CAF中的hnRNPA1去泛素化,导致外泌体miR-522的分泌增加。
化疗毒性激活成纤维细胞USP7/hnRNPA1轴促进miR-522分泌,造成胃癌化疗耐受
为了评估化疗损伤对USP7/hnRNPA1/miR-522 轴的作用,作者在三种胃成纤维细胞株分别敲除USP7,hnRNPA1和miR-522,并将这些成纤维细胞株与SGC7901细胞混合用于小鼠皮下肿瘤植入。从第十天开始,每5天给这些荷瘤小鼠注入顺铂或生理盐水,并在第30天收获肿瘤。在CAF中敲除USP7,hnRNPA1或miR-522可观察到抑制肿瘤生长并增强对顺铂的敏感性,上调了lipid-ROS水平。从小鼠肿瘤中分离出的原发性CAF,敲除USP7会降低hnRNPA1蛋白质水平。 CAFs中三个基因的抑制都会导致ALOX15在癌细胞中的上调。顺铂的处理相对促进了CAFs中USP7 / hnRNPA1以及癌细胞中ALOX15的表达,但ALOX15的mRNA几乎没有变化。从这些小鼠中分离出血浆外泌体,外泌体miR-522的水平在USP7-KD和hnRNPA1-KD组中显示出急剧下降。铁死亡的标志物PYGS2明显上调,而凋亡的标志物CASP3随着CAF中USP7,hnRNPA1和miR-522的敲低而略有增加。抑制USP7,hnRNPA1,miR-522后,顺铂处理荷瘤小鼠生存期延长。
对于大多数进展期肿瘤来说,化疗是其治疗的主要手段。如何提高化疗效果减少化疗抵抗增加化疗敏感性是临床急需解决的问题。本文揭示一个新的CAFs外泌体与癌细胞铁死亡的机制,即通过USP7/hnRNPA1/miR-522 轴对癌细胞铁死亡进行调节。USP7促进hnRNPA1去泛素化使miR-522分选进入CAFs外泌体,从而使铁死亡相关蛋白ALOX15的表达显著下调,lipid-ROS累积导致细胞铁死亡。而敲低USP7,hnRNPA1,miR-522,提示可以增强顺铂化疗的敏感性。
参考文献1. Haiyang Zhang, Ting Deng, Rui Liu et al., CAF secreted miR-522 suppresses ferroptosis and promotes acquired chemoresistance in gastric cancer, Molecular Cancer (2020) 19:43.2. Stockwell BR, Friedmann Angeli JP, Ferroptosis: a regulated cell death Nexus linking metabolism, redox biology, and disease. Cell. 2017;171: 273–85.
|  /1
/1 
 |Archiver|手机版|外泌体之家 | exosomes & microvesicles
|Archiver|手机版|外泌体之家 | exosomes & microvesicles
