|
|
本帖最后由 Johnny 于 2021-7-8 18:25 编辑
Nature Nanotechnology:细胞模拟纳米诱饵中和SARS-CoV-2并减轻COVID-19非人类灵长类动物肺损伤
由严重急性呼吸系统综合症冠状病毒2 (SARS-CoV-2) 引起的2019年冠状病毒病 (COVID-19) 已发展成为全球大流行病,迄今为止只有少数抗病毒治疗获得批准。血管紧张素转换酶2 (ACE2) 在SARS-CoV-2发病机制中起着重要作用,因为它允许病毒进入宿主细胞。近日,北卡罗莱纳州立大学程柯教授课题组在Nature Nanotechnology杂志上发表文章,报道了源自人肺球状细胞 (LSC) 的ACE2纳米诱饵(nanodecoys)可以结合和中和SARS-CoV-2,并保护宿主肺细胞免受感染。在小鼠中,这些LSC-纳米诱饵通过吸入疗法递送,并在递送后在肺部停留超过72小时。此外,吸入 LSC-纳米诱饵加速了SARS-CoV-2模拟物从肺部的清除,没有观察到毒性。在用活SARS-CoV-2攻击的食蟹猴中,四剂这些通过吸入递送的纳米诱饵促进了病毒清除并减少了肺损伤。研究结果表明,LSC-纳米诱饵可以作为治疗COVID-19的潜在治疗剂。

血管紧张素转换酶2(ACE2)存在于许多细胞类型中,且几乎存在于所有组织中,是一种羧肽酶,在病毒进入宿主细胞中起关键作用。SARS-CoV-2通过其刺突蛋白与ACE2的相互作用,特异性攻击肺部中呈递ACE2的II型肺细胞和鼻粘膜中的杯状分泌细胞。该研究利用病毒的细胞进入策略作为特洛伊木马来欺骗病毒。在过去的七年里,作者的实验室已经开发出肺球状细胞 (LSC) 作为治疗肺纤维化和炎症的细胞疗法,从最初的啮齿动物研究做到了正在进行的1期临床试验(NCT04262167)。LSC是常驻肺上皮细胞(包含I型和II型肺细胞)和间充质细胞的混合物。作为常驻肺细胞,它们表达ACE2,因此作者制造了LSC膜纳米囊泡作为ACE2纳米诱饵。这些作为细胞模拟物的LSC-纳米诱饵能够与SARS-CoV-2刺突(S)蛋白结合并触发巨噬细胞的吞噬反应,从而消除病毒。
人们已经开发出治疗性抗体和融合抑制剂来靶向SARS-CoV-2的刺突蛋白。然而,已经发现了与SARS-CoV-2刺突蛋白突变相关的更具攻击性的变异。因此,基于病毒用来进入宿主细胞的人类受体ACE2而非病毒成分的抗病毒策略应该引起更大的兴趣,因为预计宿主细胞不会发生突变。作者的研究数据支持中和SARS-CoV-2的潜在非侵入性治疗策略。该方法与目前使用的两种策略(抗病毒药物和疫苗)有根本不同。用于制造纳米诱饵的LSC是通过稳健、可重复和可扩展的培养方法产生的,适用于生产临床适用数量的细胞治疗产品。此外,这种纳米诱饵技术具有高度的可转化性,因为亲本细胞目前处于早期临床试验阶段,作为肺纤维化的潜在治疗方法。
LSC-nanocoys的制造
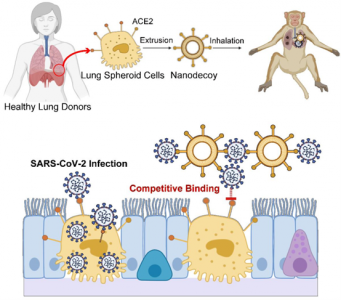
补充图1、从肺球体细胞产生纳米诱饵和用于SARS-CoV-2感染的纳米诱饵疗法的示意图
该研究的纳米诱饵设计的总体原理如上面补充图1所示。首先,针对ACE2表达筛选LSC及其亲本细胞、肺外植体衍生细胞 (EDC),以确定纳米诱饵制造的最佳细胞类型。通过免疫染色、免疫印迹和流式细胞术分析LSC和EDC的ACE2表达。此外,使用免疫印迹和流式细胞术作为对照研究了HEK293和人肺成纤维细胞的ACE2表达水平。发现LSC的ACE2表达水平高于其他细胞类型,包括它们的母细胞EDC。相比之下,HEK293和成纤维细胞的ACE2表达明显较低。先前的研究表明,肺组织中83%的表达ACE2的细胞是II型肺细胞,这表明肺是SARS-CoV-2病毒最脆弱的靶器官。因此,结果表明,作为原代肺细胞,LSCs可能是产生具有高水平ACE2表达的纳米诱饵的理想细胞类型。相比之下,HEK293细胞可被用作制备具有低水平ACE2表达的纳米诱饵的对照。
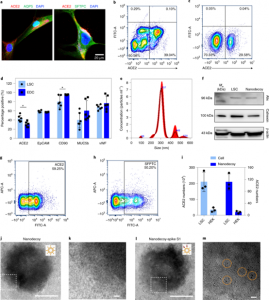
图1、肺球体细胞(LSCs)衍生纳米诱饵的表征
LSC和HEK293膜纳米囊泡(nanodecoys)是通过将LSC或HEK293细胞连续通过孔径为5 μm、1 μm 和最终0.4 μm的聚碳酸酯膜商用挤出机挤出产生的。获得的LSC-nanodecoys通过纳米粒子追踪分析进行表征,结果表明由5 × 10[size=0.625em]6个细胞产生的均匀纳米粒子群平均大小为320 nm,平均浓度为5.51 × 10[size=0.625em]10粒子ml-1(图 1e)。换句话说,平均而言,一个LSC产生了11,020个纳米诱饵。由于使用全细胞制备纳米诱饵,作者怀疑纳米诱饵不仅由质膜产生,也由细胞内膜产生。为了证实该假设,作者还通过检测了Alix和 Calnexin来研究纳米诱饵的细胞内成分。结果显示检测到这两种细胞内标记,这支持了该假说(图 1f)。流式细胞术分析证实了ACE2(图 1g)以及 II 型肺细胞标记物SFTPC(图 1h)保留在纳米诱饵表面。此外,通过酶联免疫吸附试验 (ELISA) 研究了LSC和HEK293细胞及其纳米诱饵上ACE2 的数量。ACE2的丰度被确定为每个LSC有2.1 × 106个受体,每个LSC-nanodecoy有112个受体。与此形成鲜明对比的是,在每个HEK293细胞和HEK-nanodecoy上分别发现仅3.4 × 10[size=0.625em]5和10个ACE2受体(图 1i)。此外,透射电子显微镜(TEM)图像揭示了纳米诱饵的球形形态(图 1j,k)。
COVID-19灵长类动物模型中的纳米诱饵疗法
在证实纳米诱饵可对刺突蛋白S1发挥中和作用、在体外对 SARS-CoV-2模拟病毒起中和作用、检测吸入后纳米诱饵的生物分布、证明纳米诱饵吸入可加速清除小鼠模型中SARS-CoV-2模拟病毒后,作者进行了一项试点非人类灵长类动物研究,以评估LSC-纳米诱饵的安全性和初步治疗效果。食蟹猴模型可以概括SARS-CoV-2感染的许多临床症状,并在上呼吸道和下呼吸道显示出强大的病毒复制。六只食蟹猴通过鼻内和气管内途径感染SARS-CoV-2(图6a)。感染后,将动物随机分为两个治疗组:在感染后第2、3、4和5天吸入PBS或LSC-纳米诱饵(剂量为每公斤体重10[size=0.625em]10个粒子)。支气管肺泡灌洗液 (BAL) 和鼻拭子 (NSs) 中的病毒载量通过实时PCR对病毒亚基因组RNA (sgRNA,指示病毒复制)进行评估。结果,在对照动物中观察到高水平的sgRNA,BAL中的中值峰值为6.243log10 RNA 拷贝ml-1,第2天NSs中每个拭子的中值峰值为5.595 log10 RNA拷贝(图 6b,c)。在纳米诱饵处理的动物中,sgRNA水平显著降低,在感染后第8天,BAL和NSs中 sgRNA 的中值峰值降低到<1.70 log10。尽管对照和LSC-nanodecoy组的sgRNA水平随时间下降,但LSC-nanodecoy治疗诱导了更快速的病毒清除。有趣的是,LSC-nanodecoy组的温度和体重波动并不像对照组动物那样剧烈。
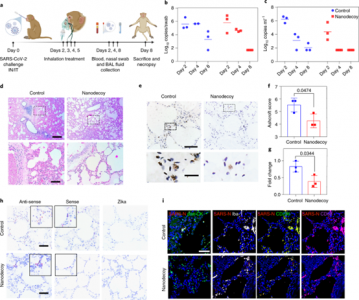
图6、LSC-nanodecoy吸入治疗食蟹猴的SARS-CoV-2感染
结论
该研究在活体SARS-CoV-2感染的非人类灵长类动物模型中提供了证据,表明细胞衍生和细胞模拟纳米诱饵可以保护肺细胞免受SARS-CoV-2引起的感染和损害。食蟹猴模型概括了人类COVID-19患者的许多临床特征。在SARS-CoV-2感染后8天,四剂纳米诱饵吸入导致BAL和NS中的病毒载量减少。未观察到体重减轻、发热或死亡等不良事件。肺组织的组织病理学、免疫组织化学、RNAscope和免疫荧光分析表明,纳米诱饵不仅能有效减轻炎症细胞浸润和减少肺纤维化,更重要的是,能够降低SARS-N和vRNA的水平。因此,该研究结果表明,LSC-nanodecoys可以作为治疗COVID-19的潜在治疗剂。
参考文献:
LiZ, Wang Z, Dinh PC, Zhu D, Popowski KD, Lutz H, Hu S, Lewis MG, Cook A,Andersen H, Greenhouse J, Pessaint L, Lobo LJ, Cheng K. Cell-mimickingnanodecoys neutralize SARS-CoV-2 and mitigate lung injury in a non-humanprimate model of COVID-19. Nature Nanotechnology. 2021Jun 17. PMID: 34140674.
附件已隐藏,回复该贴可查看附件 附件已隐藏,回复该贴可查看附件
|
本帖子中包含更多资源
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
|
 /1
/1 
 |Archiver|手机版|外泌体之家 | exosomes & microvesicles
|Archiver|手机版|外泌体之家 | exosomes & microvesicles
