|
|
天津大学&天津医科大学 磷脂酰胆碱工程化的外泌体用于增强的肿瘤细胞摄取和胞内抗肿瘤药物递送
近日,来自天津大学的侯信教授和赵瑾副教授、天津医科大学的康春生教授合作在Macromolecular Bioscience杂志上发表文章,报道了通过工程化设计外泌体的膜脂质组成来增强外泌体的肿瘤细胞摄取和胞内药物递送的有效策略。这种策略通过简单的孵育,将两亲性磷脂酰胆碱(PC)分子插入血液来源的网织细胞外泌体(Exos)的膜脂质层中,以构建PC改造的外泌体(PC-Exos)。与天然Exos相比,PC-Exos表现出显着增强的肿瘤细胞内化效率和速率,增加了近两倍。加载治疗剂后,PC-Exos显着促进肿瘤细胞胞内药物或RNA的积累,从而在体外显示出增强的抗肿瘤活性。这项工作证明了工程化改造外泌体膜脂质在调节其肿瘤细胞摄取中的关键作用,这将有助于设计基于外泌体的高效药物递送载体。

改善与肿瘤细胞的相互作用效率是工程化设计天然或合成药物递送载体的共同目标。在最近的几十年中,天然载体,例如外泌体,已被广泛用作各种治疗性货物的递送载体,包括化疗剂,核酸和免疫调节剂等。与合成载体相比,外泌体的独特优势是其天然来源,使它们能够逃避免疫清除,具有延长的循环半衰期并表现出最佳的生物相容性。从大规模生产和临床安全性的角度来看,非恶性细胞衍生的外泌体是药物递送载体的理想候选者,例如Wood等人发明的树突状细胞衍生的外泌体,以及干细胞衍生的或存在于体液(例如血液和牛奶)中的外泌体。但是,与肿瘤来源的外泌体相比,这些外泌体自身与肿瘤细胞相互作用的能力较弱。有证据表明,癌细胞衍生的外泌体显示出高的肿瘤细胞内化效率,其与肿瘤细胞的结合和内化程度明显高于源自健康细胞的外泌体,高达四倍之多。因此,为了实现有效的药物递送,工程化非肿瘤来源的外泌体以改善其肿瘤细胞摄取效率是必要的,并且肿瘤外泌体可以作为参照。
通过模拟肿瘤外泌体,已经进行了积极的尝试来改善外泌体的肿瘤特异性生物利用度,这其中主要依赖于膜蛋白的功能化。通过将膜蛋白与特异性结合肿瘤细胞上过表达的αv整合素的iRGD肽融合来工程化设计外泌体,可以增加外泌体与肿瘤细胞的结合,从而增强摄取效率和抗肿瘤作用。同样,用叶酸修饰外泌体是可行的,叶酸是一种用于癌症靶向的高亲和力配体,使得与肿瘤细胞的相互作用增强。除膜蛋白外,膜脂质在肿瘤细胞衍生的外泌体与肿瘤细胞的相互作用中也起着关键作用。有证据表明,胶质瘤来源的外泌体的独特脂质成分对于其有效的肿瘤细胞摄取至关重要。同样,对模拟PC3细胞衍生的外泌体脂质含量构建的脂质体的研究表明,脂质成分有助于促进细胞粘附和内在化。黑色素瘤细胞来源的外泌体中脂质的富集通过增加其膜的刚性而正向影响其与肿瘤细胞融合的能力。受这些特征的启发,对非肿瘤细胞源性外泌体进行工程改造的合理假设是使用肿瘤外泌体的独特脂质成分来重构其膜脂质,以改善其肿瘤细胞摄取和胞内药物传递效率。
该研究报道了一种简单而灵活的方法,通过用磷脂酰胆碱(PC)调节其脂质成分来增强网织红细胞(RTC)衍生外泌体的肿瘤细胞摄取效率,从而更高效地在细胞内递送治疗剂。作为安全和丰富的外泌体的来源,网织红细胞在成熟期间每天释放约10[size=0.625em]14个外泌体。这些外泌体没有任何免疫和癌症刺激活性,并且输血的安全性和常规性证明了同种异源RTC外泌体在药物递送中的临床应用潜力。据报道,磷脂酰胆碱在间充质干细胞衍生的外泌体中被耗尽,但在胶质瘤细胞衍生的外泌体中富集。因此合理设想,当用PC修饰RTC来源的外泌体的脂质成分以构建PC工程化的外泌体时,它可以模拟与肿瘤细胞发生强相互作用的肿瘤来源外泌体的功能特性,从而促进外泌体的肿瘤细胞摄取效率,最终实现了治疗剂的高效胞内递送。基于此假设,可通过简单的孵育将两亲性PC脂质分子掺入Exos的脂质层中。结果证明使用PC来调节膜脂质成分可以提高外泌体的肿瘤细胞内化效率和速率,最多可增加两倍。将此出色的细胞内化性能和外泌体的天然药物负载能力相结合,PC-Exos可以有效地将药物或RNA输送至癌细胞,从而在体外抑制肿瘤细胞增殖。
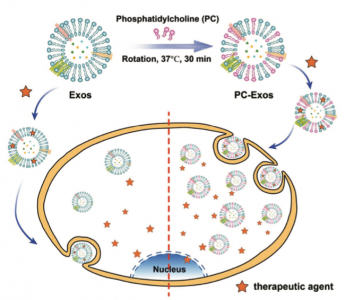
示意图:通过用PC分子工程化设计Exos的膜脂质组成来制备PC-Exos,以及增强的肿瘤细胞摄取和治疗剂的胞内递送的过程。 参考文献:Qi Zhan,Kaikai Yi, Xueping Li, Xiaoteng Cui, Eryan Yang, Ning Chen, Xubo Yuan, JinZhao, Xin Hou, and Chunsheng Kang. Phosphatidylcholine-Engineered Exosomes for Enhanced Tumor Cell Uptake and Intracellular Antitumor Drug Delivery,Macromolecular Bioscience 2021; 2100042. doi: 10.1002/mabi.202100042
|
|
 /1
/1 
 |Archiver|手机版|外泌体之家 | exosomes & microvesicles
|Archiver|手机版|外泌体之家 | exosomes & microvesicles
