|
|
本帖最后由 Johnny 于 2021-6-26 21:07 编辑
Nature Metabolism:COVID-19不同阶段细胞外囊泡的多组学和功能研究
外泌体代表细胞外囊泡的一种亚型,通过多囊泡体与质膜的融合而释放。尽管目前还没有完美的方法来高通量、无偏地分离纯血浆外泌体,但对富含外泌体的血浆细胞外囊泡成分的研究可以在系统水平上一瞥内吞途径。近日,中国科学院遗传与发育生物学研究所税光厚教授、解放军总医院第五医学中心王福生教授、首都医科大学北京地坛医院张福杰教授、解放军总医院第五医学中心宋锦文教授等合作在Nature Metabolism杂志发表文章,对来自COVID-19不同时间阶段(包括症状前、高炎症、消退和恢复期)患者的富含外泌体的细胞外囊泡(EV)进行了高覆盖率的脂质组学(重点是甾醇和氧甾醇)和蛋白质组学分析。研究强调了EV脂质膜各向异性变化的基础上失调的筏脂质代谢,这些变化改变了早老蛋白-1(PS-1)在高炎症期的外泌体定位。体外研究表明,来自不同时间阶段的EV在受体细胞中触发不同的代谢和转录反应,包括在代表感染原发部位的肺泡上皮细胞和代表远端次级部位的肝细胞中。与高炎症期相比,来自消退期的EV对真核翻译和Notch信号传导产生相反的影响。研究结果提供了对COVID-19不同阶段细胞脂质代谢和组织间串扰的见解,并且是增加我们对COVID-19代谢失调理解的资源。

根据世界卫生组织(WHO)的COVID-19数据,截至2021年6月上旬,COVID-19已感染全球超过17亿人,全球因COVID-19死亡的人数超过 370万。尽管COVID-19主要是由SARS-CoV-2引起的传染病,但这种感染会引发无数代谢紊乱,这可能会改变疾病进程的轨迹和最终结果。COVID-19发病机制的时间过程以病毒介导的对宿主代谢的直接影响以及宿主对病原体的反应引起的附带损害为标志。
最初被认为是细胞排泄不需要的物质的一种手段,后来的研究表明外泌体参与细胞间通讯,特别是在病毒传播和免疫反应方面。作为脂质双层封闭结构,EV表现出不同的脂质膜成分,具体取决于其母细胞的性质和生理状态。据报道,COVID-19中富含外泌体的EV的膜脂组成发生了严重程度相关的变化。由于外泌体主要来自内吞途径中超过一半的膜胆固醇集中的MVB,胆固醇稳态对外泌体生物学和功能产生重要影响。胆固醇稳态被确定为介导SARS-CoV-2感染人类细胞的关键宿主途径。胆固醇与鞘磷脂 (SM) 也形成有序的筏膜微域,可微调膜流动性并改变蛋白质定位。例如,γ-分泌酶 (GS) 裂解NOTCH-1以形成Notch细胞内结构域和β-淀粉样前体蛋白 (APP) 以形成β-淀粉样肽 (Aβ),在脂筏中显示优先定位和增强的活性。因此,EV膜的脂质成分可能会改变GS的定位和活性,从而调节与COVID-19病理相关的下游通路。
该研究根据与入院和出院日期相关的样本收集日期、SARS-CoV-2 RNA 检测结果和相关实验室发现将血浆样本分配到四个时间阶段。在四个疾病阶段中未观察到基线特征(年龄、性别和体重指数)的显著差异。在有症状的高炎症 (S2) 阶段观察到轻微的凝血功能障碍,表现为血小板计数减少和血浆乳酸脱氢酶水平升高。这些观察结果证实了COVID-19患者在病程早期出现明显凝血功能障碍的先前临床发现。与先前研究的结果一致,疾病轨迹上的免疫细胞谱表明对SARS-CoV-2感染的先天免疫反应延迟和抑制。淋巴细胞和T细胞计数直到S2阶段才减少,伴随着从C反应蛋白的急剧增加中明显增加的过度炎症。与患者血液样本相关的临床发现支持根据COVID-19幸存者的疾病轨迹将其分为免疫抑制、症状前(S1)阶段,然后是症状性、高炎症(S2)阶段以对抗内源性病毒载量。包括消退(S3)和恢复期(S4)阶段的疾病轨迹的下一部分主要由宿主驱动(即SARS-CoV-2 RNA阴性),其特征是炎症逐渐消退(包括淋巴细胞计数和炎症标志物的恢复)。
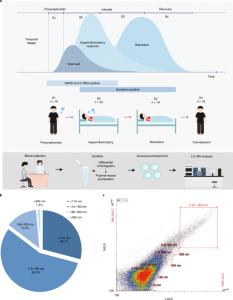
沿着COVID-19的时间进程研究EV组成
该研究使用差速离心和基于聚合物的沉淀从78个 COVID-19 患者的时间血浆样本中分离富含外泌体的EV。通过纳米流式细胞术分析验证了分离的EV的尺寸分布,与EV的理论尺寸(<200 nm)一致,其中>85%的EV是颗粒<180 nm,>98% 的EV是颗粒< 300 nm。相对于上清液和血浆,分离的 EV 富含外泌体特异性标志物,包括TSG101、CD9和CD63。与加载等量总蛋白质的全血浆样品相比,未检测到可能的血浆污染物的标记蛋白(膜联蛋白 A1作为微泡标记;ApoB和ApoE作为脂蛋白标记)。分离的EV的透射电子显微镜图像显示,囊泡呈现出杯状囊泡形态,这是外泌体的特征,尺寸约为100nm。这些观察结果支持分离的EV富含外泌体。使用高效液相色谱-串联质谱法(HPLC-MS/MS),定量分析了富含外泌体的EV的脂质组,重点是胆固醇和植物甾醇的各种氧化衍生物,这些衍生物已知可引起免疫调节和抗病毒作用。
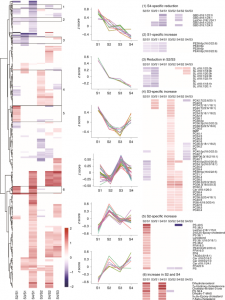
COVID-19中EV脂质组变化的不同时间模式
S2和S4 EV中的几种氧甾醇和甾醇均升高,表明系统水平上的胆固醇稳态失调。与S2相比,S1中的游离胆固醇、几种甾醇以及氧化胆固醇衍生物显著减少。被广泛认为是阻碍病毒复制的抗病毒化合物S1特异性氧甾醇的减少证实了正在进行的病毒复制和免疫反应迟钝的临床状态。例如,最近被证明可以在体外抑制两种人类冠状病毒(SARS-CoV-2和HCoV-OC43)复制的27-羟基胆固醇在S1 EV中特别减少。
包含142个已鉴定蛋白质的EV蛋白质组的主成分分析表明,S1和S2阶段分离良好。使用差异表达蛋白(DEP)的KEGG通路富集分析显示补体和凝血级联以及血小板激活是COVID-19过程中最主要的失调通路。S1 EV中补体C1r和C1s的明显增加,但补体C1q没有。相比之下,S2 EV蛋白质组以宿主驱动的反应为标志,以遏制病毒传播。在S2 EV中观察到整合素β3的增加,据报道其通过阻断病毒与ACE2受体的结合来抑制SARS-CoV-2的细胞内进入。
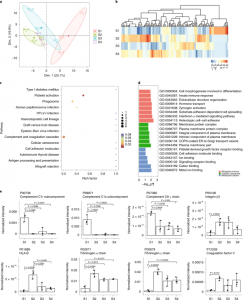
COVID-19四个阶段的EV蛋白质组的时间变化
从过度炎症阶段到消退阶段的过渡标志着疾病进程的关键转折点。研究观察到筏脂质的比例升高,并进一步验证了与消退期相比,高炎症期EV膜各向异性增加。
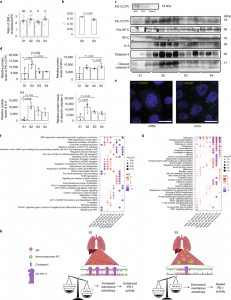
脂质膜各向异性改变EV的组成和功能
总之,该研究对富含外泌体的EV的脂质组和蛋白质组的组成变化进行了不同阶段的分析,并提供了基于组学的证据,证明了COVID-19临床轨迹期间潜在的代谢后果。改变EV脂质膜流动性可以改变蛋白质货物的定位,来自COVID-19不同阶段的EV具有不同的生物学属性。特别是,研究发现来自消退阶段的富含外泌体的EV在体外触发了对细胞代谢的相反影响,因此可能能够抵消高炎症S2 EV引起的细胞反应。尽管本研究中未表征的不同蛋白质和RNA货物也可能有助于确定的EV功能,但该研究表明,与消退的S3期相比,在高炎症S2期中增强的PS-1定位到富含外泌体的EV有助于它们在受体细胞上不同的细胞反应。这些数据还可以作为未来研究的有用信息库,以阐明COVID-19发病机制中代谢失调和后果的潜在机制线索。
参考文献:LamSM, Zhang C, Wang Z, Ni Z, Zhang S, Yang S, Huang X, Mo L, Li J, Lee B, Mei M,Huang L, Shi M, Xu Z, Meng FP, Cao WJ, Zhou MJ, Shi L, Chua GH, Li B, Cao J,Wang J, Bao S, Wang Y, Song JW, Zhang F, Wang FS, Shui G. A multi-omicsinvestigation of the composition and function of extracellular vesicles alongthe temporal trajectory of COVID-19. Nature Metabolism.2021 Jun 22. PMID: 34158670.
|
本帖子中包含更多资源
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
|
 /1
/1 
 |Archiver|手机版|外泌体之家 | exosomes & microvesicles
|Archiver|手机版|外泌体之家 | exosomes & microvesicles
